癌症,是无数家庭的噩梦,而“转移”更是让无数患者和家属感到绝望的词语。当癌细胞从原发部位扩散到身体的其他器官,病情往往变得更加复杂和难以控制。然而,近年来科学界的一个突破性发现,正逐渐揭开癌症转移背后一个被忽视的“时间密码”:我们身体内部的“生物钟”,也就是昼夜节律,竟然在其中扮演着举足轻重的作用。这不仅让我们对癌症转移有了全新的理解,更预示着未来抗癌治疗可能走向一个全新的方向——“时间疗法”。
您是否曾疑惑,为什么有些癌症治疗效果不佳,有些癌细胞特别“顽固”?为什么即使手术切除了原发肿瘤,癌细胞还是会卷土重来?答案可能就隐藏在您每天的作息习惯、睡眠质量,以及您身体内那看不见、摸不着的“生物钟”里。今天,MedFind将带您深入探讨由权威期刊《Cancer Letters》最新综述文章揭示的,昼夜节律紊乱与肿瘤转移的深层联系,以及它如何为我们开启抗癌治疗的新思路,帮助您更好地理解病情,寻找更有效的治疗方案。
一、癌症转移:一场与时间的赛跑
癌症转移,简单来说,就是癌细胞从最初生长的部位(比如肺部)“跑”到身体其他地方(比如肝脏、骨骼或大脑)并安营扎寨,继续生长。这就像一场残酷的马拉松,癌细胞努力冲破重重障碍,寻找新的落脚点。转移性疾病是晚期癌症患者面临的主要死亡原因,因为它意味着癌症已经扩散到多个器官,治疗难度大大增加。
过去,我们可能认为癌细胞的扩散是随机发生的,但最新的研究颠覆了这一观念。科学家们发现,肿瘤转移并非一个随意、均匀分布的过程,而是受到体内“昼夜节律”的精确调控。这意味着,癌细胞的“旅行”和“定居”行为,竟然也遵循着一个内部的时间表。
权威期刊《Cancer Letters》在2025年11月发表了一篇题为《昼夜节律紊乱介导的癌症转移:从分子机制到临床意义及启示》的综述文章。该文章首次提出了昼夜节律紊乱是转移可塑性的“时间守门人”这一创新观点。它告诉我们,癌细胞不仅会利用我们自身昼夜节律的失调来变得更具侵略性,还会通过改变自身的行为(比如逃避免疫系统、建立新的生长环境)来促进转移。理解这个“时间守门人”的工作原理,对于我们制定更有效的抗癌策略至关重要。
二、人体“生物钟”:昼夜节律的奥秘与重要性
要理解昼夜节律如何影响癌症,我们首先要了解它本身是什么。
1. 什么是昼夜节律?
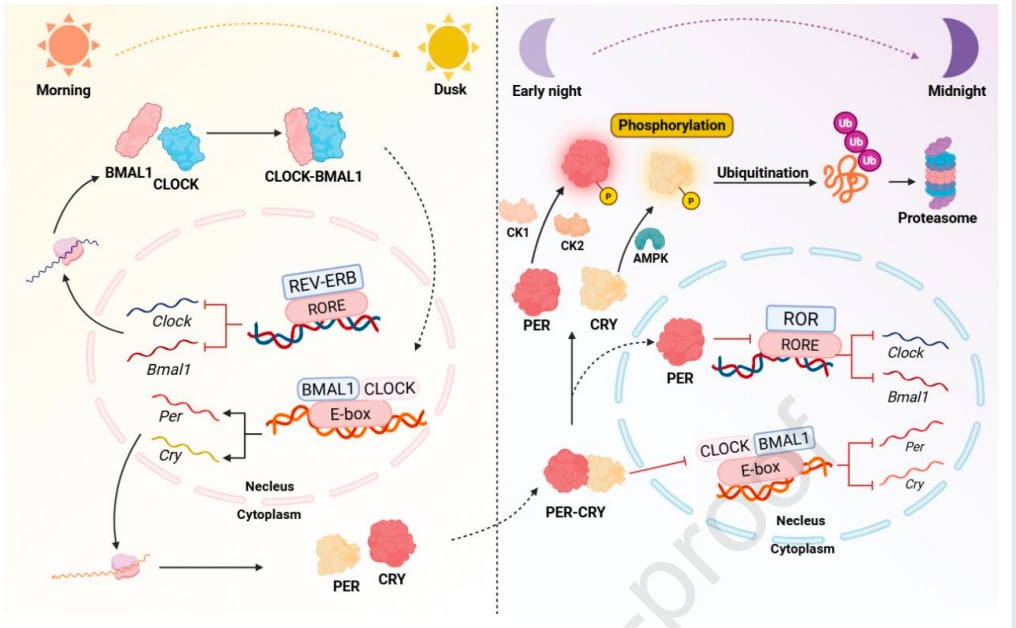
昼夜节律,通俗来说就是我们身体的“生物钟”。它是一个大约24小时的循环周期,深深影响着我们从睡眠、觉醒、吃饭、新陈代谢到体温、激素分泌等几乎所有的生理活动和行为。想象一下,您的身体内部有一个精密的时钟,它协调着您白天工作、晚上休息的节奏,让您能够适应地球的昼夜变化。
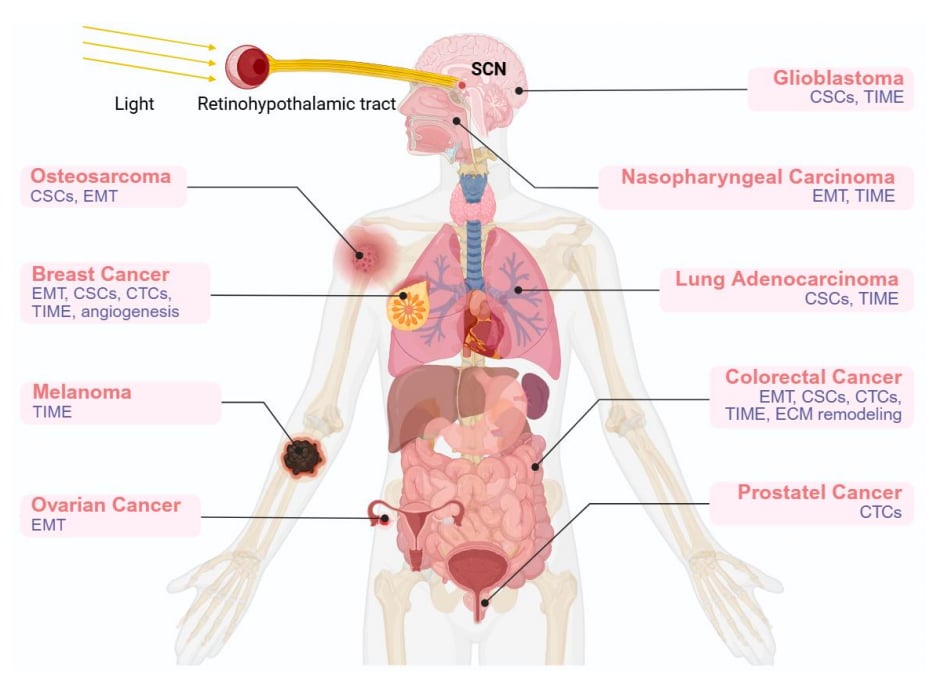
这个“生物钟”的普遍性和重要性,使得三位科学家在2017年获得了诺贝尔生理学或医学奖,以表彰他们对昼夜节律分子机制的发现。我们的“主生物钟”位于大脑深处的视交叉上核(SCN),它像一个总司令,接收来自眼睛的光信号,然后向下丘脑、甲状腺、肝脏、胰腺、骨骼肌和心脏等外周器官发送信号,同步全身的生物钟,确保身体各个部分的“时间”都对得上。
2. 昼夜节律紊乱的危害
不幸的是,现代生活中的许多因素都可能扰乱我们的昼夜节律,比如:
- 夜间光照过多:手机、电脑屏幕的蓝光会抑制褪黑素分泌,影响睡眠。
- 轮班工作:长期夜班或不规律的班次会让身体难以适应。
- 时差反应:跨时区旅行导致身体内外时钟不匹配。
- 慢性睡眠障碍:如失眠、睡眠呼吸暂停等。
当昼夜节律被打乱,不仅仅是睡眠质量会受影响,更重要的是,它可能悄无声息地增加我们患各种疾病的风险。例如,有研究显示,长期睡眠障碍的女性患甲状腺癌的风险显著升高。还有研究表明,睡眠不足会影响肠癌细胞的脂肪代谢,进而促进结肠癌向肝脏转移。
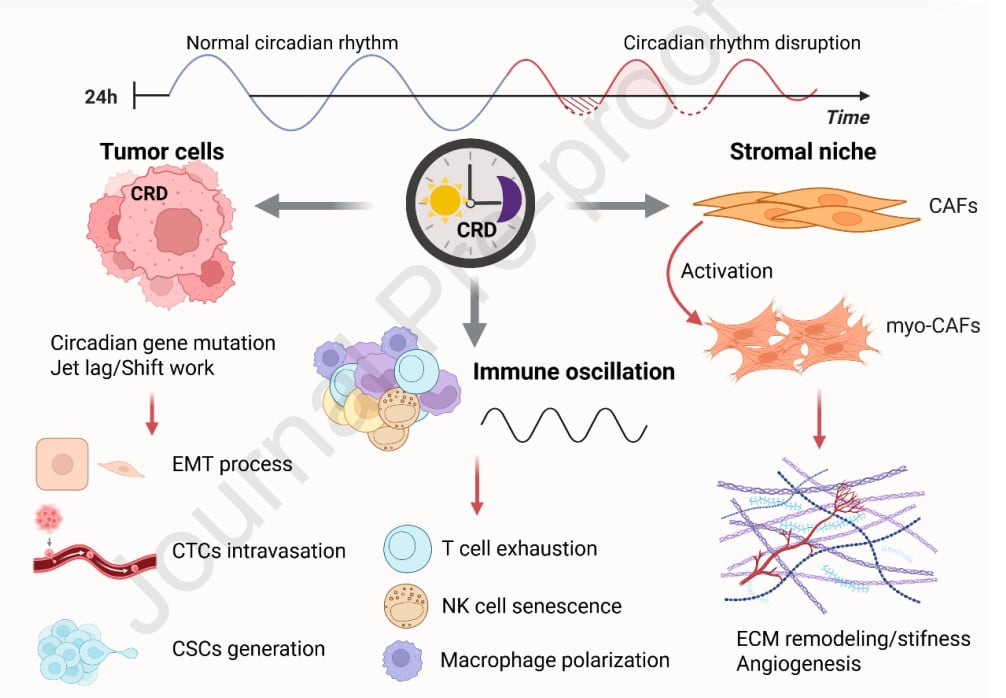
更深层次的研究发现,昼夜节律紊乱不仅会激活肿瘤周围的基质细胞(肿瘤相关成纤维细胞),促进癌细胞的扩散和“变身”(上皮-间质转化),还会影响癌细胞中的“超级细胞”(癌症干细胞)以及血液中游走的癌细胞(循环肿瘤细胞)。甚至,肿瘤细胞自身也可能发展出一种能与宿主节律同步的“生物钟”,来促进自身的生长和转移。
这些发现都强有力地表明,昼夜节律紊乱与癌症的发生发展,特别是转移过程,有着千丝万缕的联系。
三、昼夜节律紊乱如何“助推”癌症转移?核心机制大揭秘
昼夜节律紊乱就像一个“幕后推手”,几乎影响了肿瘤转移的整个过程,包括癌细胞的侵袭、扩散和最终在远处器官的定植。接下来,我们将从几个关键方面深入探讨这一复杂的分子机制。

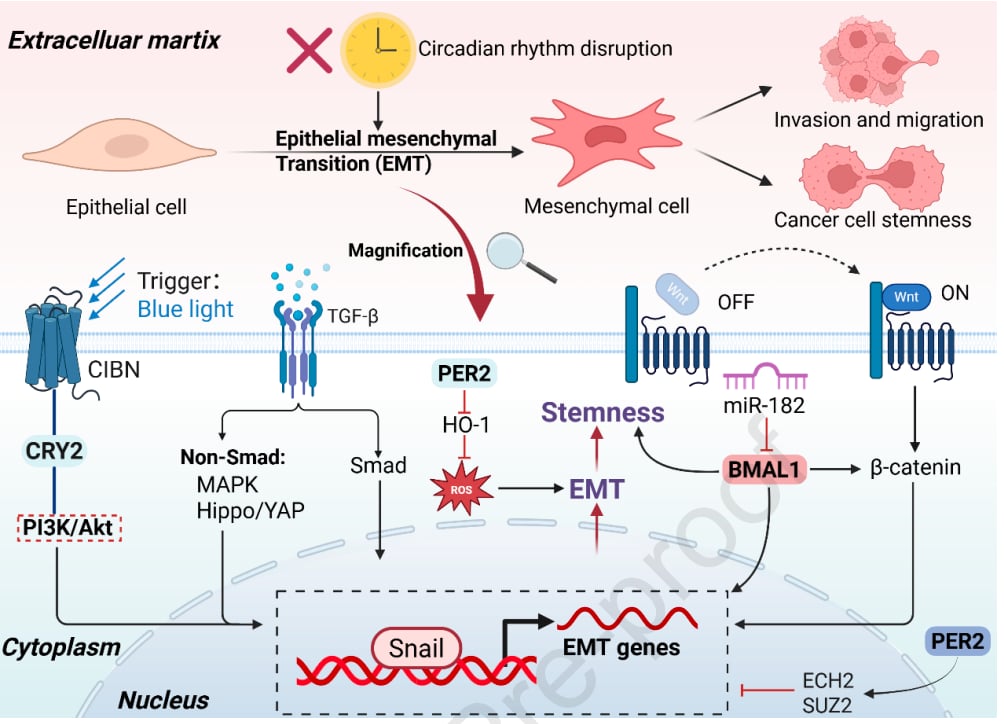
1. 癌细胞的“变身”:上皮-间质转化(EMT)
上皮-间质转化(EMT)是癌细胞获得转移能力的关键一步。正常情况下,上皮细胞排列整齐,紧密相连。但在EMT过程中,它们会“变身”为更像间质细胞的形态,失去原有的极性,细胞间的连接断裂,变得松散,更像“游牧民族”,能够从原发肿瘤中脱离,四处游走,并更具侵袭性。
研究发现,昼夜节律紊乱会显著影响EMT过程:
- 正向调节因子作祟:核心生物钟基因如BMAL1和CLOCK,通常被认为是昼夜节律的“激活者”。然而,在许多癌症中,BMAL1的异常表达反而会促进EMT。例如,它能诱导特定蛋白的积累,激活信号通路,从而增强结直肠癌细胞的迁移和侵袭能力。而在鼻咽癌中,BMAL1则扮演了一个“矛盾”的角色,有时反而能抑制EMT,这表明生物钟基因的作用具有癌症类型特异性。
- 负向调节因子的失职:昼夜节律的“抑制者”CRY和PER蛋白家族,在多种肿瘤中通常发挥抑制EMT的作用。例如,PER2能阻止一些促进EMT的基因表达,而当PER2减少时,EMT就会被激活,肿瘤侵袭性增强。但在某些特殊情况下,例如蓝光照射下,CRY2的激活也可能诱导EMT,这表明生物钟基因的调控机制极其复杂。
总而言之,当身体的“生物钟”失调时,癌细胞就更容易启动EMT,变成更具侵略性、更容易转移的“变形金刚”。
2. 癌症的“种子”:癌症干细胞(CSCs)的繁殖与转移
癌症干细胞(CSCs)被认为是肿瘤的“种子”,它们在癌细胞群体中数量稀少,但却拥有强大的自我更新能力和分化潜能。这意味着它们可以不断产生新的癌细胞,对放化疗的抵抗性更强,而且是肿瘤转移的关键驱动因素。如果没有这些“种子”细胞在远处器官存活并生长,肿瘤很可能停滞在微转移阶段,甚至被免疫系统清除。
昼夜节律紊乱对CSCs的影响也非常显著:
- 促进干性:研究表明,慢性时差反应(例如长期倒班)会显著增强癌症的“干性”,驱动癌细胞扩散和转移。在乳腺癌中,特定的微小RNA(miR-182)通过抑制BMAL1表达,导致一种与恶性程度高度相关的酶(醛脱氢酶)活性升高,从而增强CSCs的侵袭能力。
- 抑制干性:相反,生物钟抑制因子PER2的升高则能通过调节信号通路抑制胶质瘤干细胞的侵袭。一些天然成分,如绿茶中的L-茶氨酸,也能通过调控生物钟相关的信号通路来抑制肺癌细胞的干性和迁移能力。
这说明,昼夜节律的正常运转,对于抑制这些“超级癌细胞”的形成和转移至关重要。
3. 血液中的“幽灵船队”:循环肿瘤细胞(CTCs)
循环肿瘤细胞(CTCs)是指从原发肿瘤脱落,进入血液或淋巴系统,在身体里“游荡”的癌细胞。它们是肿瘤转移的“先遣部队”。虽然大多数CTCs会在血液循环中被清除,但少数能逃避免疫监视并聚集在一起形成“循环肿瘤细胞簇”,其转移潜力更高。一旦到达远处器官,这些CTCs就可能“安营扎寨”,形成新的肿瘤。
令人惊讶的是,CTCs进入血管的过程并非随机,而是受到昼夜节律的调控:
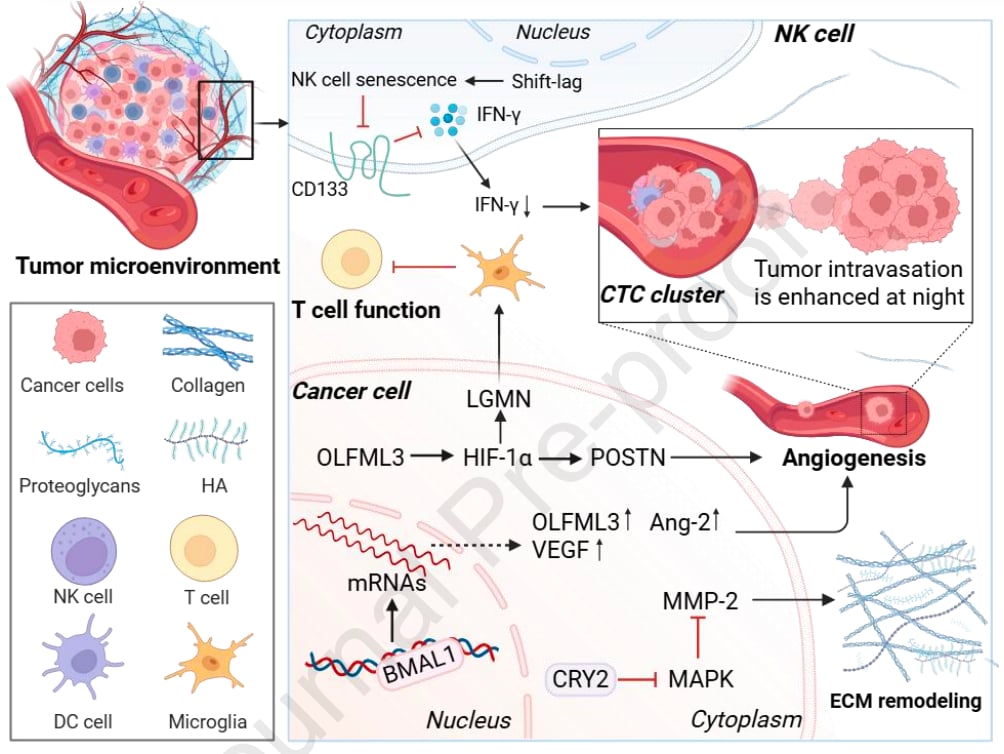
- 夜间“出逃”高峰:多项研究发现,无论是前列腺癌小鼠模型还是乳腺癌患者,CTCs的数量在夜间或静息期会爆发性增长,达到动态峰值。这意味着,癌细胞在患者休息的时候,更可能在体内进行“远征”,寻找新的转移点。
- 激素与基因的推动:这种夜间转移能力的增强,可能与昼夜节律性激素的波动有关。单细胞RNA测序显示,夜间富集的增殖基因显著上调,这些基因可能驱动癌细胞在夜间进行转移性扩散。
这一发现对癌症治疗具有深远意义,它提示我们,针对CTCs的治疗或许可以考虑“时间窗”,在癌细胞最活跃的夜晚进行干预,以达到更好的效果。
4. 癌细胞的“温床”:肿瘤微环境(TME)的改造
肿瘤微环境(TME)是癌细胞周围的“土壤”和“生态系统”,它包含癌细胞本身、各种基质细胞、免疫细胞、血管细胞以及细胞外基质(ECM,如胶原蛋白、弹性蛋白)和可溶性因子(如细胞因子)。这个复杂的环境与癌细胞协同作用,驱动肿瘤的生长、进展和免疫逃逸。昼夜节律紊乱会对TME产生深刻影响,从而促进肿瘤转移。
(1) 免疫系统:昼夜节律的双刃剑
我们的免疫系统是抗癌的第一道防线,但免疫细胞的功能和迁移也受昼夜节律的调控。当昼夜节律紊乱时,免疫系统的抗癌能力可能受损,从而为癌细胞的转移创造有利条件。
- 抗癌免疫细胞的削弱:自然杀伤(NK)细胞和CD8 T细胞是重要的抗癌“战士”,它们具有显著的昼夜节律性。研究发现,当昼夜节律被打乱,例如PER2基因缺失时,NK细胞的活性会下降,分泌的细胞因子减少,杀伤癌细胞的能力也随之减弱。慢性轮班工作引起的昼夜节律紊乱也会加速NK细胞衰老,降低其功能,从而促进黑色素瘤肺转移。
- 促癌免疫细胞的激活:昼夜节律紊乱还可能促进巨噬细胞分泌促炎症因子,招募单核细胞形成促炎症微环境,从而加速肿瘤进展。在胶质母细胞瘤中,CLOCK蛋白通过上调特定分子,招募脑内小胶质细胞(一种免疫细胞),抑制免疫功能并增强癌症干细胞的干性特征。
- 免疫检查点分子的异常上调:昼夜节律失调会诱导T细胞“疲惫”,并导致PD-L1和CTLA-4等免疫检查点分子系统性上调,这些分子会帮助癌细胞逃避免疫系统的攻击。
因此,昼夜节律的正常运转对于维持强大的抗肿瘤免疫反应至关重要。它的紊乱会重编程免疫细胞的代谢和能量供应,损害免疫效应细胞功能并促进肿瘤免疫逃逸,最终导致癌细胞的转移扩散。
(2) 血管生成:癌细胞的“生命线”
随着肿瘤体积的增大,它需要更多的氧气和营养。于是,癌细胞会诱导身体生成新的血管来供养自己,这个过程叫做血管生成。新形成的血管不仅为癌细胞提供营养,也成为癌细胞进入血液循环、实现转移的“高速公路”。
昼夜节律紊乱同样会影响血管生成:
- 促进因子与抑制因子:传统观点认为,核心生物钟基因BMAL1通过调控血管内皮生长因子(VEGF)等关键因子来驱动肿瘤血管生成。例如,在胶质母细胞瘤中,BMAL1水平与微血管密度相关。但在某些情况下,BMAL1的调控更为复杂,它可能通过其他细胞周期调节因子影响血管生成。而PER和CRY等负向调节因子通常会抑制血管生成。
- 紊乱的血管生长:昼夜节律紊乱通过改变血管内皮细胞和成纤维细胞的活性,显著增强血管生成,为癌细胞的扩散提供更多通道。
这意味着,通过调节昼夜节律,我们可能能够“掐断”癌细胞的营养供应,阻碍其血管生成,从而抑制转移。
(3) 细胞外基质重塑:铺设转移“高速公路”
细胞外基质(ECM)是细胞外由胶原蛋白等组成的“脚手架”,它构成了细胞赖以生存和移动的微环境。在癌症中,这个“脚手架”会被癌细胞和周围的基质细胞改造,变得更有利于癌细胞的侵袭、迁移和转移,这个过程称为细胞外基质重塑。
昼夜节律紊乱通过多种机制影响ECM重塑:
- 影响降解酶:核心生物钟基因BMAL1被证明能调控基质金属蛋白酶(MMP-9)的表达和活性,这些酶能“消化”ECM,为癌细胞开辟道路。BMAL1通过激活某些信号通路,最终促进乳腺癌细胞的侵袭和转移潜能。但也有相反的研究表明,BMAL1可能通过抑制其他MMP酶来降低肺癌和胶质瘤的侵袭性,再次强调了其作用的情境依赖性。
- 改变基质硬度:基质硬度对肿瘤细胞转移至关重要。高硬度的基质就像为癌细胞提供了“轨道”,引导它们定向侵袭。研究发现,昼夜节律紊乱可以改变癌症相关成纤维细胞(CAF)的功能,促进它们分泌更多的结构蛋白,从而增强基质硬度,进而促进癌细胞的侵袭。
可见,昼夜节律紊乱能从多个层面改造肿瘤微环境,为癌细胞的转移提供“天时地利”。
5. 肠道菌群与昼夜节律的“共谋”
除了上述机制,一个令人惊讶的发现是,昼夜节律紊乱竟然会影响我们的肠道菌群。而肠道菌群的失衡,反过来又会加剧某些癌症(如结直肠癌)的肺转移。研究表明,昼夜节律紊乱会导致小鼠肺部聚集更多的髓源性抑制细胞(MDSCs)和功能失调的CD8 T细胞,形成一种有利于转移的微环境。甚至,肠道微生物的代谢产物(如牛磺胆酸)也能促进MDSCs的免疫抑制功能,进一步助长转移。
四、针对昼夜节律:抗癌转移治疗的新策略
既然昼夜节律紊乱是肿瘤转移的“时间守门人”,那么通过调节它,能否开发出新的抗癌策略呢?答案是肯定的!目前,主要有两种有前景的治疗方向:靶向昼夜节律的药物和“时辰疗法”。
1. 靶向昼夜节律的药物
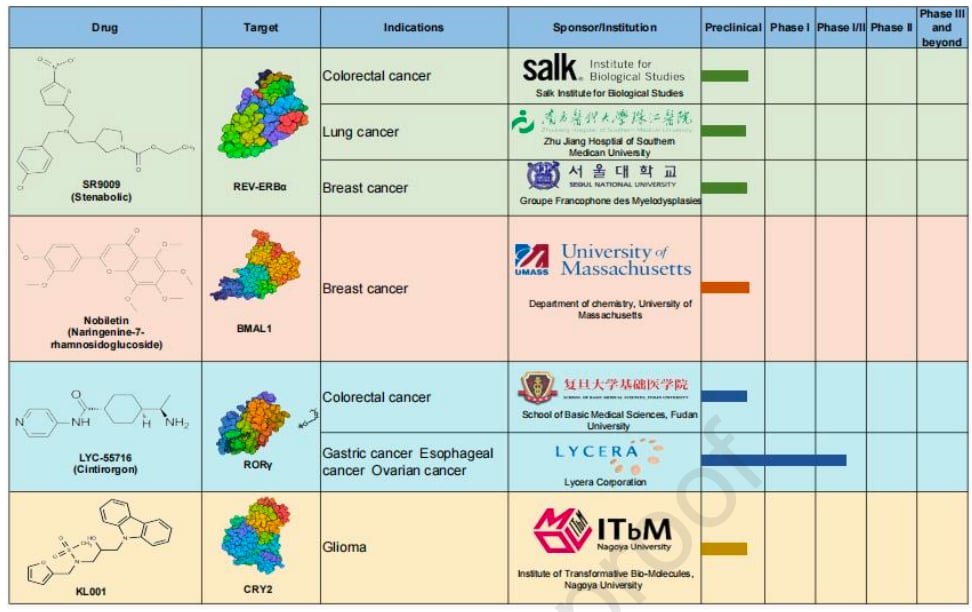
科学家们正在积极研发能够调节生物钟核心蛋白的药物。这些药物旨在纠正紊乱的昼夜节律,从而抑制肿瘤进展和转移。
- 激活因子激动剂:
研究发现,一种名为SR9009的药物,能特异性激活REV-ERBα蛋白,这种蛋白是生物钟的负向调节因子。SR9009在黑色素瘤、白血病、结直肠癌和肺癌模型中,能增强T细胞介导的免疫反应,从而抑制肿瘤生长和肺转移。
此外,被称为BMAL1激动剂的川陈皮素,能帮助乳腺癌细胞恢复正常的昼夜节律,从而抑制其增殖和迁移。
RORγ激动剂LYC-55716则能增强CD8 T细胞的功能,逆转免疫抑制的肿瘤微环境。在一项早期临床试验中,LYC-55716已显示出减少胃癌、食管癌和卵巢癌转移负荷的初步疗效。 - 调节抑制因子:
KL001及其衍生物SHP是首批被识别的CRY调节剂,它们能优先抑制CRY2,从而抑制胶质母细胞瘤干细胞的活性,产生抗癌效果。
然而,需要注意的是,这些靶向昼夜节律的药物目前大多仍处于临床前研究阶段,面临着巨大的转化挑战。例如,SR9009的口服生物利用度很低,血浆半衰期短,且可能存在脱靶效应。未来的研究需要将严谨的机制探索与人体试验相结合,以确保这些药物的疗效和安全性。
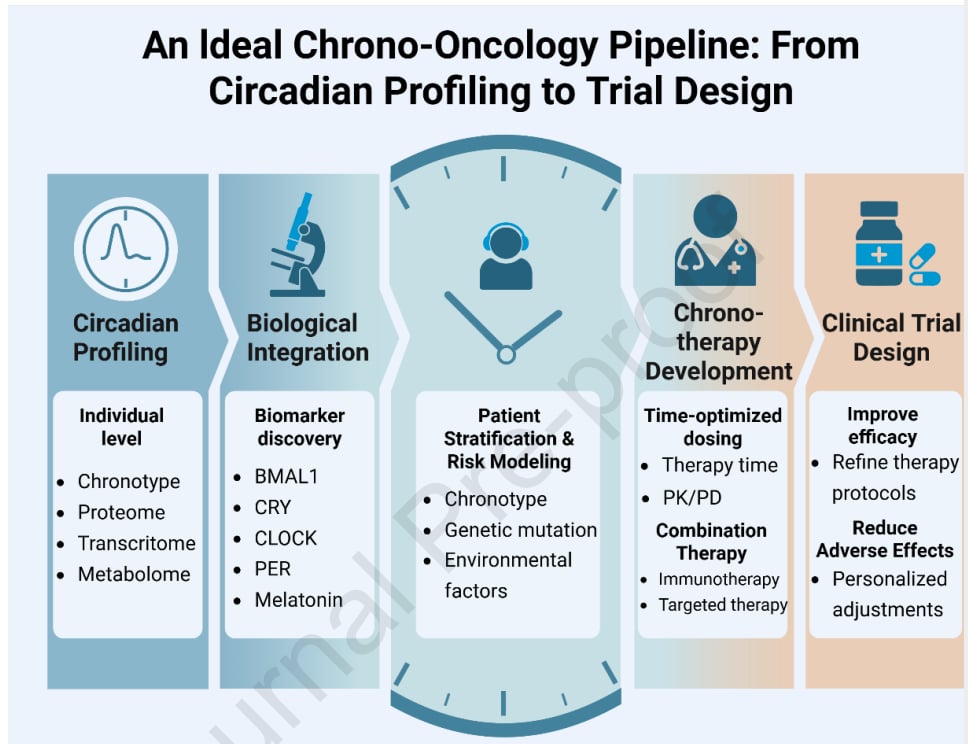
2. “时辰疗法”:在对的时间做对的治疗
“时辰疗法”,也称为时间疗法或时相疗法,是利用生物钟原理来优化治疗方案,选择在一天中最佳的时间点给药,以期提高药物疗效,同时最大限度地减少副作用。这项理论基础早在20世纪80年代就已建立,并随着对昼夜节律分子机制理解的深入而迅速发展。
- 化疗的“时间艺术”:
化疗是许多恶性肿瘤的一线治疗方法。研究表明,通过优化给药时间,可以显著增强化疗效果。例如,对于结直肠癌的标准化疗药物5-氟尿嘧啶,夜间输注给药能够获得更稳定的血浆浓度,并将结直肠癌肝脏转移的风险降低30%。
在小鼠模型中,有节律地给予环磷酰胺,能有效抑制肿瘤体积和转移,这归因于其强大的抗血管生成特性。 - 免疫疗法的“黄金时段”:
免疫检查点抑制剂(ICIs)是现代癌症治疗的革命性进展,能够激活身体自身的抗肿瘤免疫反应。多项回顾性研究发现,免疫检查点抑制剂的给药时间对疗效有显著影响。
例如,对于晚期黑色素瘤患者,在下午4点30分之前给予伊匹单抗(查看购买渠道与价格)、纳武利尤单抗(查看购买渠道与价格)和/或帕博利珠单抗(查看购买渠道与价格),能够显著提高总生存期,尤其在脑转移患者中效果更明显。
另一项针对转移性非小细胞肺癌(NSCLC)的研究也显示,早晨接受纳武利尤单抗单药治疗的患者,其总生存期和无进展生存期大约是下午治疗患者的四倍。
这些令人鼓舞的发现强调了“时辰疗法”在控制肿瘤转移方面的巨大潜力。它提示我们,同样的药物,在不同的时间点使用,可能会产生截然不同的效果。然而,还需要更多前瞻性的临床试验来确定针对特定肿瘤类型的最佳给药模式,并验证给药时间对转移进展的实际影响。
值得一提的是,研究还发现,时辰疗法对男性和女性患者的效果可能存在性别差异。例如,在转移性结直肠癌患者中,男性在时辰调节治疗后表现出更优的临床结局,而女性患者则在常规治疗中获益更多。这表明昼夜节律的机制可能存在性别特异性,未来的治疗方案或许需要更加个体化。
五、未来展望与挑战:个性化“时间医学”之路
越来越多的证据表明,昼夜节律紊乱通过影响癌细胞的“变身”、转移潜能、周围微环境和免疫系统等关键过程,成为肿瘤转移的关键“时间守门人”。靶向昼夜节律通路代表了一种新兴的、有前景的癌症治疗策略。
1. 昼夜节律的复杂性与个体差异
尽管生物钟基因在癌症中发挥着广泛作用,但其对转移的影响往往具有情境依赖性,甚至可能出现矛盾的结果。例如,核心生物钟基因BMAL1在不同的癌症类型中可能扮演不同的角色,它在鼻咽癌中抑制EMT,但在大多数其他癌症中却促进EMT。这种复杂性意味着,在开发针对昼夜节律的疗法时,我们必须充分考虑肿瘤的异质性,甚至个体之间的差异。
患者在“作息类型”(晨型人或夜型人)和生活方式(睡眠质量、光照暴露、轮班工作、进餐时间)上的差异,都会极大地影响体内蛋白质或分子的节律性表达,从而重塑时辰治疗的疗效与毒性。例如,睡眠质量差会破坏肝脏药物代谢酶的节律性,可能增加药物毒性风险。
2. 现有研究模型的局限
目前对昼夜节律的研究,主要集中在核心生物钟分子的功能解析,以及使用节律紊乱的动物模型。然而,这些模型存在一定局限性:
- 分子功能与整体节律的差异:单个分子失调及其导致的疾病进展,无法完全模拟系统性昼夜节律紊乱及其病理后果。
- 物种差异:现有动物模型多基于啮齿动物(如小鼠),它们与人类在睡眠模式和昼夜节律组织上存在显著差异,这限制了研究结果向人类的转化性。
3. 新技术带来的希望:类器官、可穿戴设备与大数据
为了克服这些挑战,科学家们正在开发和整合新型实验模型和技术:
- 类器官与3D共培养系统:这些“微型器官”或“微型肿瘤”能够更好地模拟肿瘤微环境与宿主组织的互动,实现对生物钟相关节律的实时监测。
- 人源化小鼠模型:开发更多带有重组人类基因或细胞的小鼠模型,将有助于更准确地研究昼夜节律与癌症的关系。
- 实时生物标志物与可穿戴设备:通过监测褪黑激素、皮质醇等传统生物标志物,结合基因组学、蛋白质组学和代谢组学等高通量技术,我们可以识别和验证更多呈现昼夜节律性波动的生物标志物。未来,智能手表等可穿戴设备有望通过捕捉心率、体温、活动等生理节律,无创地预测个体的昼夜节律相位,从而为“个性化时辰治疗”提供指导。
- 系统生物学方法:时序组学、单细胞节律性分析和数学模型等新兴方法,正被应用于剖析昼夜节律在肿瘤生物学中的调控机制,揭示昼夜节律紊乱促进肿瘤转移的潜在机制。
这些前沿技术将帮助我们更深入地理解昼夜节律与癌症的联系,为实现真正的“个性化时间医学”铺平道路。
MedFind与您的抗癌之路
昼夜节律,这个我们日常生活中看似简单却又深奥的“生物钟”,在癌症,特别是肿瘤转移中扮演着“时间守门人”的关键角色。理解并调控这一机制,正为抗癌转移治疗带来新的希望。从靶向昼夜节律的药物,到根据身体节律优化给药时间的“时辰疗法”,未来的抗癌之路将更加注重个体化和精细化。
作为由癌症患者家属发起的平台,MedFind始终致力于为广大癌症患者和家属提供最新、最全面、最易懂的抗癌资讯和药物信息。我们深知您对抗癌新希望的渴求。MedFind不仅为您整理全球前沿的诊疗进展,更协助您构建安全、高效的抗癌药品跨境直邮渠道,让您能够及时获取全球最新、最有效的药物。此外,我们的AI辅助问诊服务,能帮助您初步了解病情,对接专业医学专家。
我们鼓励您与MedFind的医学专家团队进行咨询,共同探讨如何将这些前沿研究成果,如“时辰疗法”的潜力,融入到您的个性化治疗方案中。也许,掌握身体的“时间密码”,正是您战胜癌症、控制转移的关键一步。让我们携手,用科学的力量,点亮抗癌之路的希望。





