这是继武田的莫博替尼之后,国庆假期期间又一项因为II期研究被加速批准适应症然后因为III期确证性研究失败而面临退市风险的药物!突发,武田的莫博替尼要退市了,团队会解散吗?
2021年5月28日,全球首个KRAS抑制剂索托拉西布基于一项单臂II期研究CodeBreaK 100被FDA加速批准上市,用于后线KRAS G12C突变NSCLC患者。但是,随着后期III期确证性研究CodeBreaK 200中OS的失败,索托拉西布所获批的适应症被推向风口浪尖。
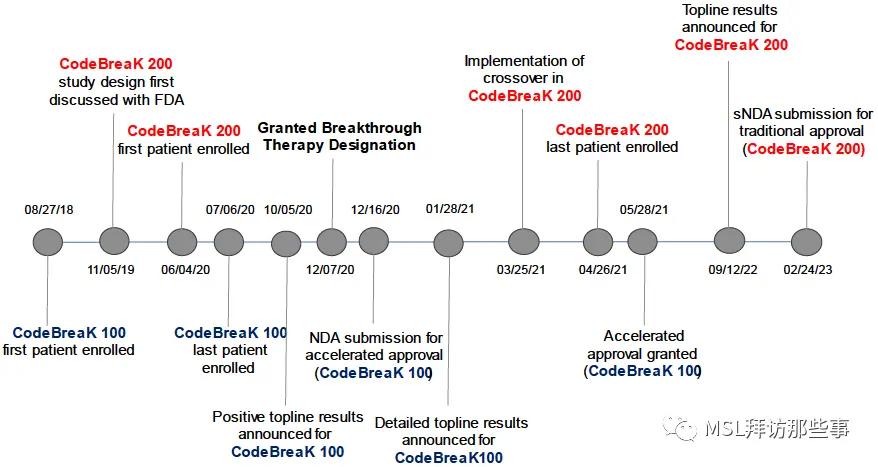
2023年10月5日,FDA召开为时近6小时的会议,对安进公司提交的关于索托拉西布的补充资料进行探讨。
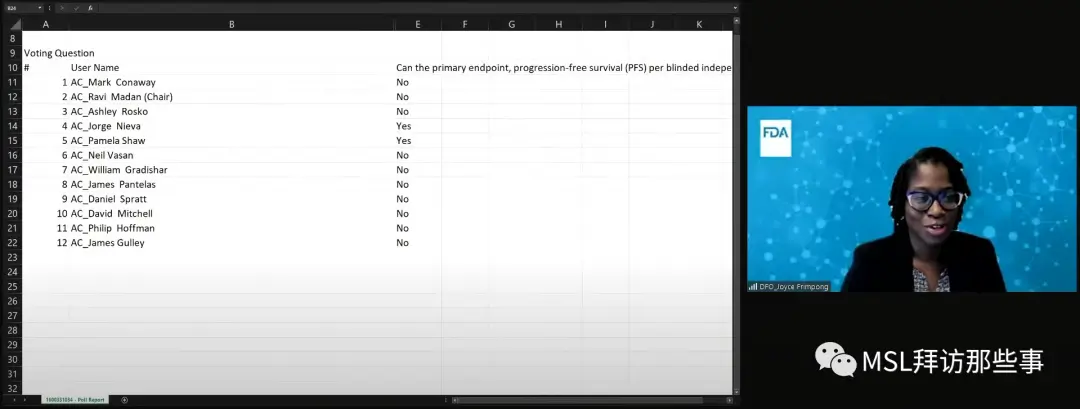
在投票环节,第一个问题是:您认为CodeBreaK 200的BICR评估的PFS能够可靠的被解释吗?12位专家中,有10位(83%)投了反对票。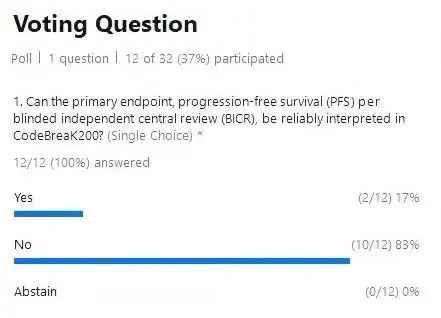
之所以对PFS进行郑重其事的表决,是因为在CodeBreaK 200这项三期研究中,不仅设置了PFS做主要研究终点,还设置了包括OS在内的关键次要终点,也就是说OS结果也是具有统计学效力的。
研究设计如下图(两种不同的表述方式,第二种能看出OS是关键次要研究终点):
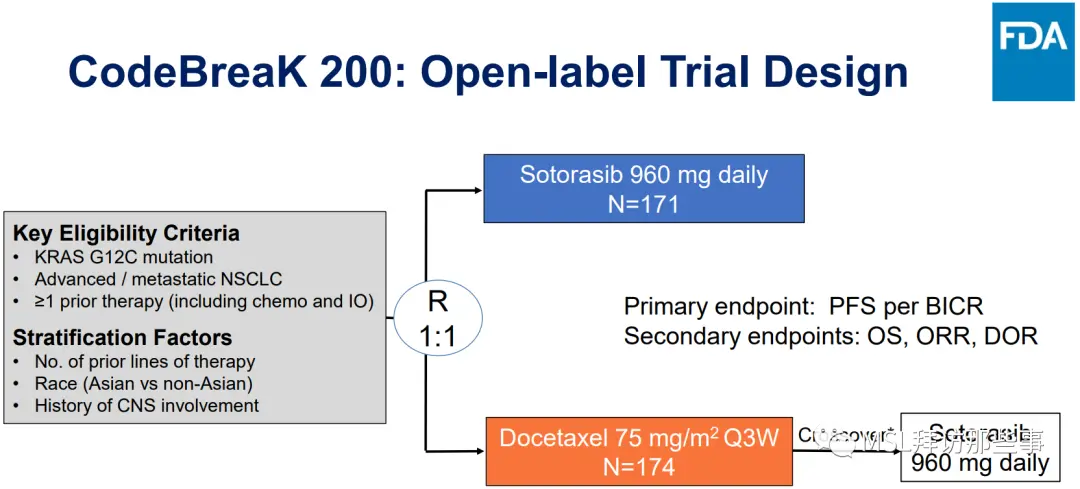
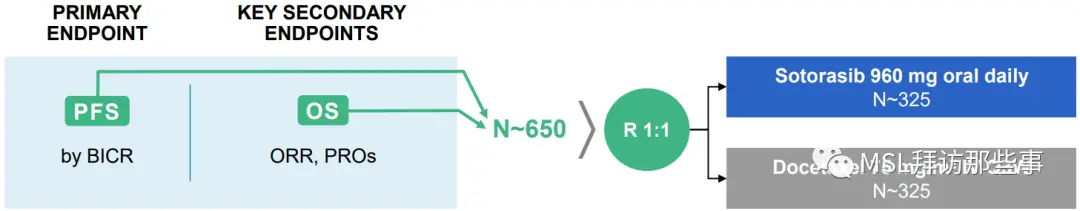
但是,我们虽然看到了主要研究终点PFS之间的差异(5.6 vs 4.5,HR 0.66(0.51,0.86)),但遗憾的是OS并没有统计学差异(10.6 vs 11.3,HR 1.01),甚至,索托拉西布组的OS在绝对值上还要略低于多西他赛化疗组。
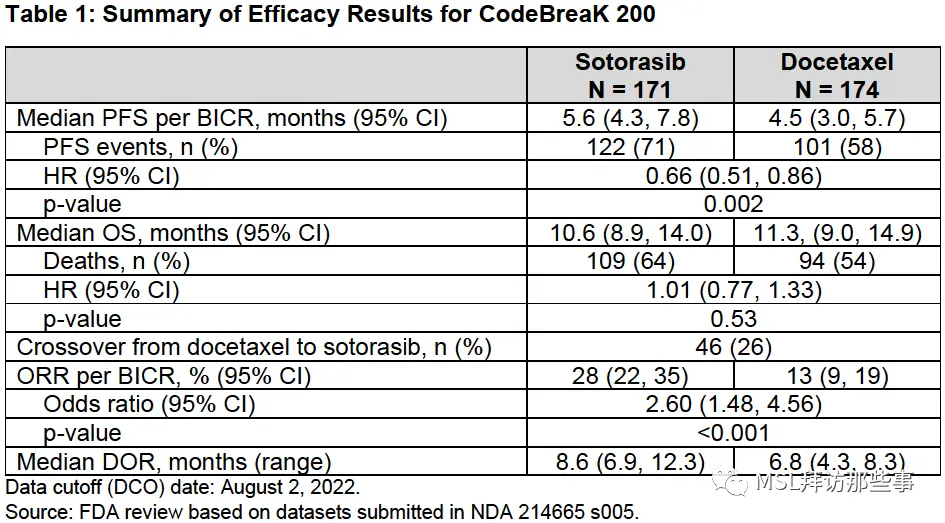
但是,基于以上OS没有获得统计学差异的研究结果,FDA并没说会直接撤销索托拉西布的适应症,而是会综合现有药品上市情况综合考虑。
之所以没有直接撤销其适应症,我想与CodeBreaK 200的研究设计是有关系的:OS是关键次要终点而不是普通的次要终点,也就是在设计之初是分配了α值计算了样本量的,所以如果OS做出了差异,那就是可信的;如果OS失败了,因为OS并不是主要研究终点而是次要研究终点(尽管是关键次要研究终点),那么也是不会被直接拒绝适应症申请的。
FLAURA2就是一个很好的例子:像CodeBreaK 200一样OS也是关键次要研究终点,所以尽管OS的初次分析并没有看到统计学差异,但是适应症的申请仍然在进行并有望获批。
下面再来看看,亚组分析,PFS2、索托拉西布在控制脑转移方面的疗效以及安全性:
PFS的亚组分析还可以,都是倾向于索托拉西布组的。
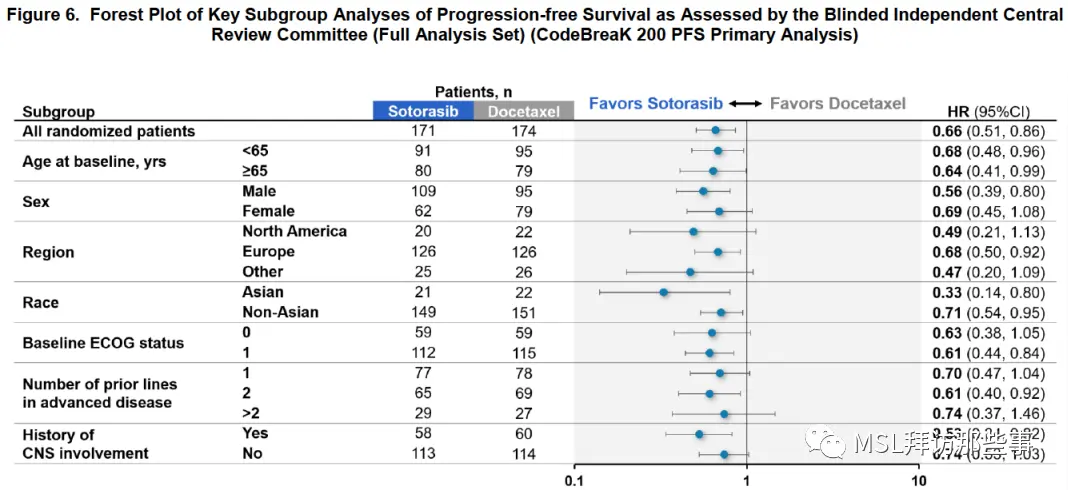
OS基本在各个亚组都凉透了。
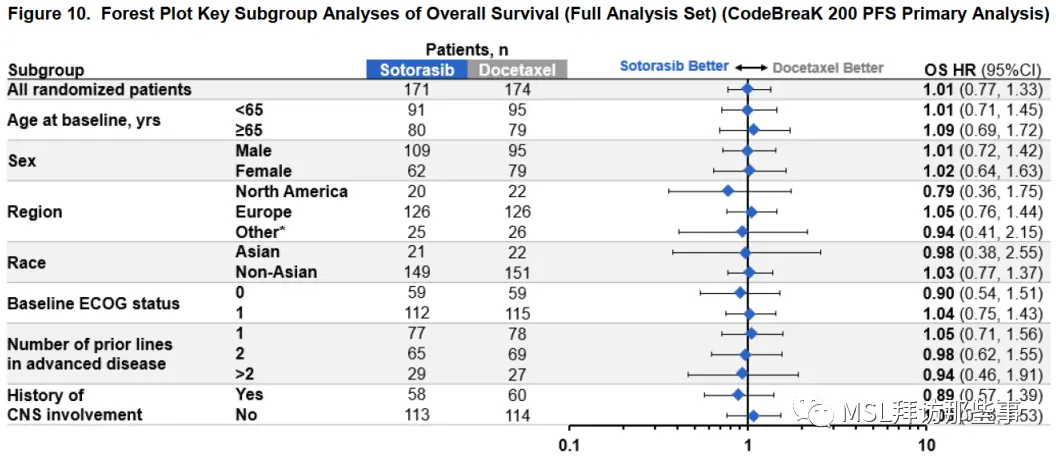
因为PFS本身的优势也才1.1个月,所以在后续治疗中PFS的获益被稀释也在情理之中,所以PFS2 HR值跨1。

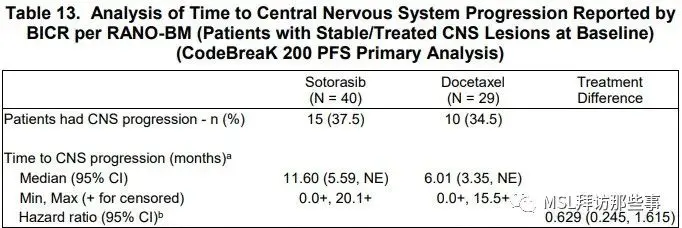
在至脑部进展时间方面,索托拉西布展示了一些优势,但是HR 0.629,95% CI上限是1.616>1。
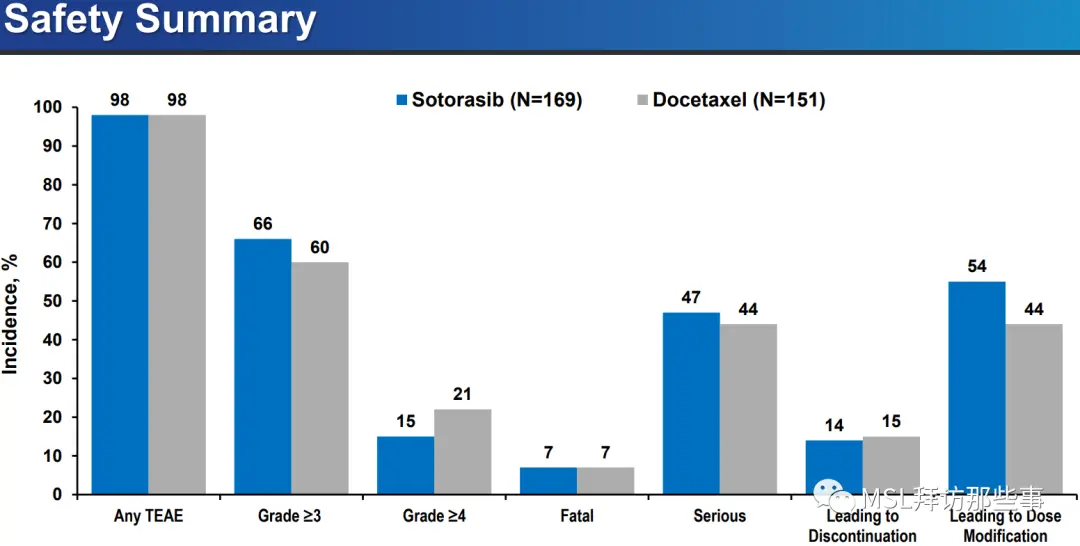
安全性上,索托拉西布基本没什么优势。