亲爱的患者朋友和家属们,当您面对难治性大B细胞淋巴瘤(LBCL)的挑战时,内心一定充满了焦虑和对新希望的渴望。近年来,CAR-T细胞疗法为许多患者带来了“起死回生”的奇迹,但仍有部分患者在治疗后复发,尤其是当癌细胞变得“狡猾”,丢失了CAR-T细胞识别的靶点时。今天,MedFind将为您深度解读一项发表在《Nature Cancer》上的重磅研究——ZUMA-14,它为难治性大B细胞淋巴瘤患者带来了新的曙光:阿基仑赛联合利妥昔单抗的双靶点治疗策略,有望克服抗原逃逸,显著提升治疗效果。
一、大B细胞淋巴瘤:不容忽视的血液肿瘤
大B细胞淋巴瘤(LBCL)是一种常见的侵袭性非霍奇金淋巴瘤,起源于淋巴细胞,主要影响淋巴结,但也可能侵犯骨髓、脾脏、肝脏等器官。这种疾病进展迅速,如果不及时治疗,可能危及生命。虽然标准的一线治疗(如R-CHOP方案)能使大部分患者获得缓解,但仍有约30-40%的患者会出现治疗失败或复发,进入“难治性”阶段。对于这些患者来说,传统的化疗效果不佳,急需更有效、更持久的治疗方案。
CAR-T疗法:希望与挑战并存
CAR-T细胞疗法,即嵌合抗原受体T细胞疗法,是近年来肿瘤治疗领域的一项革命性突破。简单来说,它通过提取患者自身的T细胞,在体外进行基因改造,使其表面表达一种能特异性识别癌细胞表面抗原(如CD19)的“导航系统”(CAR),然后将这些“武装”后的T细胞输回患者体内,精准攻击并清除癌细胞。对于难治性LBCL患者,靶向CD19的CAR-T疗法(如阿基仑赛)已显示出显著疗效,但仍有约30%的患者在接受CAR-T治疗后复发,其中一个主要原因就是癌细胞在治疗过程中丢失了CD19抗原,从而逃脱了CAR-T细胞的“追杀”,这被称为“抗原逃逸”。
二、双靶点策略:阿基仑赛联合利妥昔单抗的创新思路
既然癌细胞会丢失CD19,那我们能否同时瞄准癌细胞的另一个靶点,让它们无处可逃呢?科学家们发现,即使在CD19抗原丢失的复发性LBCL患者中,肿瘤细胞通常仍然表达CD20抗原。这为联合治疗提供了新的思路:将靶向CD19的CAR-T疗法(阿基仑赛)与靶向CD20的单克隆抗体(利妥昔单抗)结合起来,形成“双保险”,以期减少抗原逃逸,提高治疗效果。
利妥昔单抗:CD20靶向的“老将”
利妥昔单抗是一种针对B淋巴细胞表面CD20抗原的单克隆抗体,它能特异性结合B细胞表面的CD20,并通过多种机制(如抗体依赖性细胞介导的细胞毒性、补体依赖性细胞毒性等)直接杀伤B细胞,包括恶性B淋巴细胞。它在淋巴瘤治疗中已经应用多年,是许多治疗方案的基石。
三、ZUMA-14研究:疗效与安全性的深度揭示
ZUMA-14研究正是在这样的背景下应运而生。这是一项Ⅱ期、单臂、多中心临床试验,旨在评估阿基仑赛联合利妥昔单抗治疗难治性LBCL成人患者的初步安全性和疗效。研究结果近日发表于《Nature Cancer》,为我们带来了令人鼓舞的数据。
研究设计与患者入组
这项研究共纳入了27例符合条件的难治性LBCL患者,他们年龄均在18岁以上,组织学确诊为LBCL,且属于原发耐药、或至少接受过两线治疗失败、或自体造血干细胞移植后复发。其中26例患者最终接受了阿基仑赛联合利妥昔单抗的治疗。治疗方案包括标准的清淋化疗(氟达拉滨/环磷酰胺),随后单次输注阿基仑赛(目标剂量2×10⁶ CAR-T细胞/kg),并在阿基仑赛输注前5天、第21天以及之后每28天给予利妥昔单抗375 mg/m²,最多6剂。主要研究终点是研究者评估的完全缓解率(CR)。

令人振奋的疗效数据
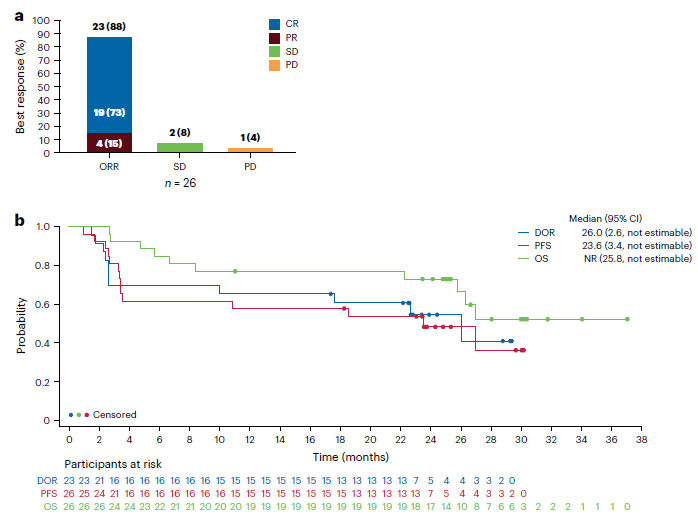
中位随访时间长达25.1个月,研究结果显示:
- 总缓解率(ORR)高达88%:这意味着绝大多数患者的肿瘤得到了有效控制或缩小。
- 完全缓解率(CR)达到73%:在26名接受治疗的患者中,有19名患者的肿瘤完全消失,这是一个非常高的比例。
- 持久缓解:在数据截止时,仍有12例(46%)患者维持缓解,这表明联合治疗的疗效是持久的。
- 中位缓解持续时间(DOR)为26.0个月:患者的缓解能够持续两年以上。
- 中位无进展生存期(PFS)为23.6个月:这意味着患者在治疗后平均有近两年时间没有疾病进展。24个月的PFS率达到48.2%。
- 24个月总生存率(OS)为72.9%:超过七成的患者在治疗两年后仍然存活,这对于难治性LBCL患者来说是巨大的进步。
值得注意的是,这些数据均优于历史对照ZUMA-1单药组(阿基仑赛单药治疗)的结果(ZUMA-1单药组的CR为53%,24个月PFS率约33%,OS率约46%)。虽然ZUMA-14研究的患者基线特征与ZUMA-1略有差异,需要谨慎解读,但联合治疗的优势已初步显现。研究还发现,有7例早期部分缓解(PR)的患者在后续治疗中转化为了完全缓解(CR),其中6例完成了全部6剂利妥昔单抗的治疗,这提示利妥昔单抗的持续使用可能对深化缓解至关重要。
微小残留病(MRD)的监测价值
研究还深入探讨了微小残留病(MRD)的监测价值。通过检测血液中的循环肿瘤DNA(ctDNA),可以评估体内是否还存在微量的癌细胞。
- 在第28天达到MRD阴性的患者中,88.9%的患者能够持续缓解,这表明早期MRD阴性是预示良好预后的重要指标。
- 而第28天MRD阳性的患者,后续复发的阳性预测值高达87.5%,这意味着如果早期MRD仍为阳性,患者复发的风险极高。
这些发现提示,ctDNA监测可以作为评估疗效和预测复发的重要生物标志物,有助于医生更早地调整治疗策略。
四、安全性与副作用管理:兼顾疗效与生活质量
任何有效的治疗都可能伴随副作用,CAR-T疗法也不例外。ZUMA-14研究对联合治疗的安全性进行了详细评估:
常见不良事件
所有患者均出现了治疗相关的不良事件(TEAEs),其中92%为≥3级。但研究者强调,并未发现新的安全信号,这意味着联合治疗并未带来意料之外的严重副作用。
- 细胞因子释放综合征(CRS):96%的患者出现了CRS,但全部为1-2级,属于轻中度,通常表现为发热、疲劳、肌肉酸痛等流感样症状,通过对症治疗(如退热、输液、甚至托珠单抗等)可以有效控制。
- 神经系统事件:62%的患者出现了神经系统事件,其中15%为≥3级,可能表现为头痛、意识模糊、言语障碍、癫痫等。这些事件通常也是可控的,在专业医护团队的监测和干预下,大多数患者都能恢复。
特殊关注的副作用
- 持续B细胞发育不全:与单药治疗相比,联合利妥昔单抗后,患者的B细胞发育不全更为明显。在治疗后12个月,92.9%的患者外周B细胞仍不可测。这可能导致免疫力下降,增加感染风险。
- 感染:尽管B细胞发育不全更明显,但≥3级感染率(23%)与ZUMA-1单药组(26%)相当,并未显著增加。这提示在严密监测和预防性治疗下,感染风险是可控的。
- 长期血细胞减少:54%的患者出现长期血细胞减少,其中38%为≥3级,可能需要输血或使用升血药物。
- 低丙种球蛋白血症:23%的患者出现低丙种球蛋白血症,可能需要定期补充免疫球蛋白以预防感染。
- 二次恶性肿瘤:有2例患者(8%)发生了二次恶性肿瘤(急性髓系白血病,AML),但研究者判定均与药物无关。
患者居家护理建议:在接受CAR-T治疗后,患者和家属应密切关注身体变化,如发热、寒战、头痛、意识改变、皮疹等,并及时告知医生。由于免疫力下降,应注意个人卫生,避免前往人群密集场所,预防感染。定期复查血常规、免疫球蛋白水平,并遵医嘱进行预防性用药。
五、药代/药效与生物标志物:精准治疗的未来
研究还深入分析了药物在体内的动力学和对生物标志物的影响:
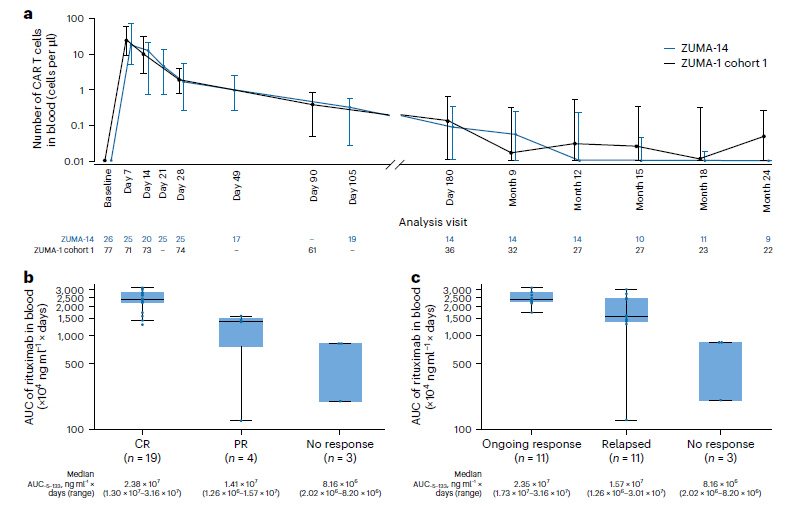
- 阿基仑赛的扩增峰值和达峰时间与ZUMA-1单药组一致,表明利妥昔单抗并未影响CAR-T细胞在体内的活性。
- 肿瘤负荷校正后,CAR-T细胞的峰值和利妥昔单抗的AUC(药时曲线下面积)均与完全缓解和持续缓解呈正相关,提示更高的药物暴露量可能带来更好的疗效。
- 基线肿瘤RNA测序显示,持续缓解的患者体内富集了NK细胞、细胞毒性及CD27/CD28/GZMA等基因,而复发/无效的患者则高表达B细胞相关的不良预后基因(如BTLA、FOXP1)。这可能有助于筛选出最适合该联合疗法的患者。
- 获得完全缓解的患者,其体内幼稚/中央记忆T细胞比例更高,而效应记忆T细胞比例更低,这提示T细胞的表型可能影响治疗效果。
六、总结与展望:MedFind助您把握治疗新机遇
ZUMA-14研究的结果令人鼓舞,它证实了阿基仑赛联合利妥昔单抗治疗难治性大B细胞淋巴瘤方案的可行性高,能够带来高达73%的完全缓解率,且缓解持久,同时并未显著增加毒性。这一“双靶点”策略(CD19+CD20)有望有效减少抗原逃逸,为克服CAR-T治疗耐药提供了新的方向。这项研究也为后续开发更先进的“双特异性CAR-T”(如CD19/20双顺反子构建)奠定了基础。
当然,这项研究仍需更大样本量、更长时间的随访来进一步验证其长期疗效和安全性。未来,研究者还将继续探索最佳的利妥昔单抗剂量和疗程,并利用生物标志物(如ctDNA、肿瘤免疫微环境)指导个体化治疗,让每一位患者都能获得最精准、最有效的治疗。
对于正在与大B细胞淋巴瘤抗争的患者和家属来说,每一次医学突破都意味着新的希望。MedFind致力于为您提供最新的抗癌资讯和药物信息,并努力帮助患者朋友构建海外购药渠道。如果您对阿基仑赛、利妥昔单抗或其他抗癌药物有任何疑问,或希望了解更多治疗方案和获取渠道,欢迎随时咨询MedFind。我们专业的团队将为您提供温暖、客观、坚定的支持,助您在抗癌路上走得更远、更稳健。