摘要
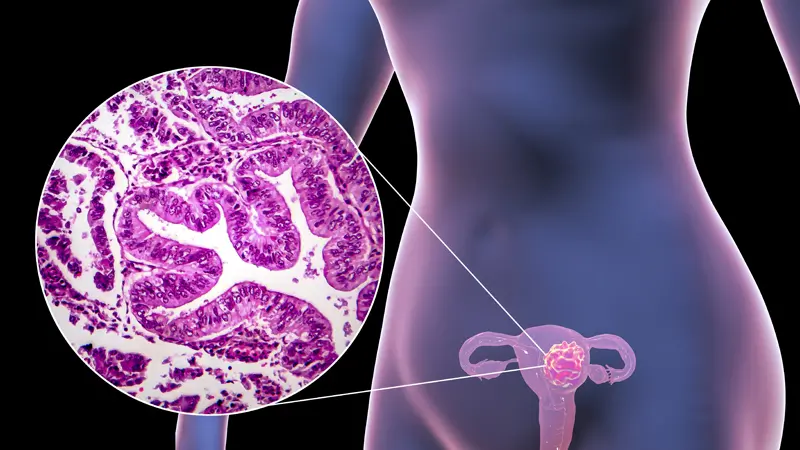
美国食品药品监督管理局(FDA)已授予前沿药Tulmimetostat(CPI-0209)快速通道认定,用于治疗晚期、复发或转移性子宫内膜癌患者。Tulmimetostat具有更强的抗肿瘤活性,根据临床试验数据,该药疗效良好并且能覆盖多种癌症,潜力非常大!
关键信息如下:
德国生物制药公司MorphoSys宣布,美国食品药品监督管理局(FDA)已授予该公司研发的新一代EZH1/2抑制剂Tulmimetostat(CPI-0209)快速通道认定,用于治疗携带ARID1A突变、先前至少接受过1种治疗后疾病进展的晚期、复发或转移性子宫内膜癌患者。