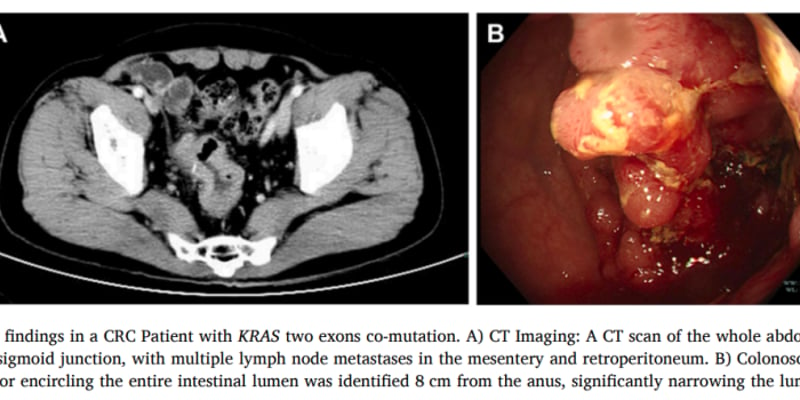
癌症免疫治疗是近年来肿瘤治疗领域最重大的突破之一,其核心在于激活患者自身的免疫系统,特别是T细胞,来识别并清除癌细胞。然而,许多患者的T细胞功能受到肿瘤微环境或内在机制的抑制,导致治疗效果不佳。清华大学陈立功/王小虎团队在权威期刊《Science Advances》上发表的最新研究,揭示了一个此前鲜为人知的T细胞“免疫刹车”机制——囊泡核苷酸转运体(VNUT),为增强抗肿瘤免疫应答提供了全新的潜在靶点。
一、癌症免疫治疗的新焦点:T细胞的“刹车”机制
T细胞,特别是辅助性T细胞(T helper cell, TH细胞),是适应性免疫反应的核心。在抗击癌症和细胞内病原体时,TH1细胞发挥着至关重要的作用。它们通过分泌干扰素-γ(IFN-γ)等促炎细胞因子,激活巨噬细胞和细胞毒性T细胞(CD8+ T细胞),从而有效地杀伤肿瘤细胞。
这项研究的核心发现是:VNUT,一种负责将三磷酸腺苷(ATP)转运到细胞内囊泡(如溶酶体)的关键蛋白,在TH1细胞中高表达,并扮演着限制TH1细胞分化和效应功能的“检查点”角色。
简单来说,当T细胞被激活时,VNUT会促进ATP从细胞内囊泡中释放到细胞外,形成细胞外三磷酸腺苷(eATP)。这种eATP随后会触发一系列信号级联反应,最终抑制TH1细胞产生关键的抗癌因子IFN-γ。因此,VNUT相当于给T细胞的抗肿瘤功能踩下了“刹车”。
什么是囊泡核苷酸转运体(VNUT)?
VNUT,也称为溶质载体家族17成员9(SLC17A9),是细胞内囊泡(如溶酶体和分泌囊泡)上的一种转运蛋白。它的主要功能是将ATP转运到这些囊泡中进行储存,并调控ATP的释放。ATP不仅是细胞的“能量货币”,当它被释放到细胞外(eATP)时,它就变成了一个重要的信号分子,被称为“危险信号”(DAMPs),参与炎症和免疫反应。
尽管eATP在先天免疫中被公认为激活剂,但在T细胞功能中的具体调控机制,尤其是其上游的释放机制,此前并不完全清楚。这项研究首次将VNUT与T细胞的特异性分化和功能抑制联系起来。
二、VNUT抑制TH1细胞功能的分子信号通路解析
研究团队通过精细的分子生物学和遗传学手段,详细解析了VNUT如何通过复杂的信号轴抑制TH1细胞产生IFN-γ。
1. eATP的释放与受体激活
当T细胞受体(TCR)被激活后,VNUT会促进溶酶体对ATP的摄取,并随后将其释放到细胞外。细胞外的eATP继而激活嘌呤能受体P2X7R。P2X7R是一种配体门控离子通道,在免疫细胞中广泛表达,对免疫调节至关重要。
2. 信号级联反应的启动
P2X7R被激活后,会引发一系列下游信号级联反应,包括:
- 钙离子内流增强: 导致细胞内钙离子浓度升高。
- JNK和FOXO3a的过度磷酸化: 这是抑制信号的关键步骤。JNK(c-Jun N-末端激酶)和FOXO3a(叉头框转录因子O3a)是T细胞分化和存活的关键调节因子。过度磷酸化通常会改变这些蛋白的活性或定位。
3. 核心转录因子Eomes的损伤
研究发现,JNK和FOXO3a的过度磷酸化最终会损害由Eomesodermin(Eomes)介导的IFN-γ产生。Eomes是一种T-box转录因子,与T-bet协同作用,是驱动TH1细胞极化和IFN-γ分泌的决定性因素。
因此,整个信号轴可以概括为:VNUT → eATP释放 → P2X7R激活 → JNK/FOXO3a过度磷酸化 → Eomes功能受损 → IFN-γ产生减少。 这一复杂的通路确立了VNUT是限制TH1免疫应答的一个关键检查点。
三、临床前证据:抑制VNUT显著增强抗肿瘤免疫
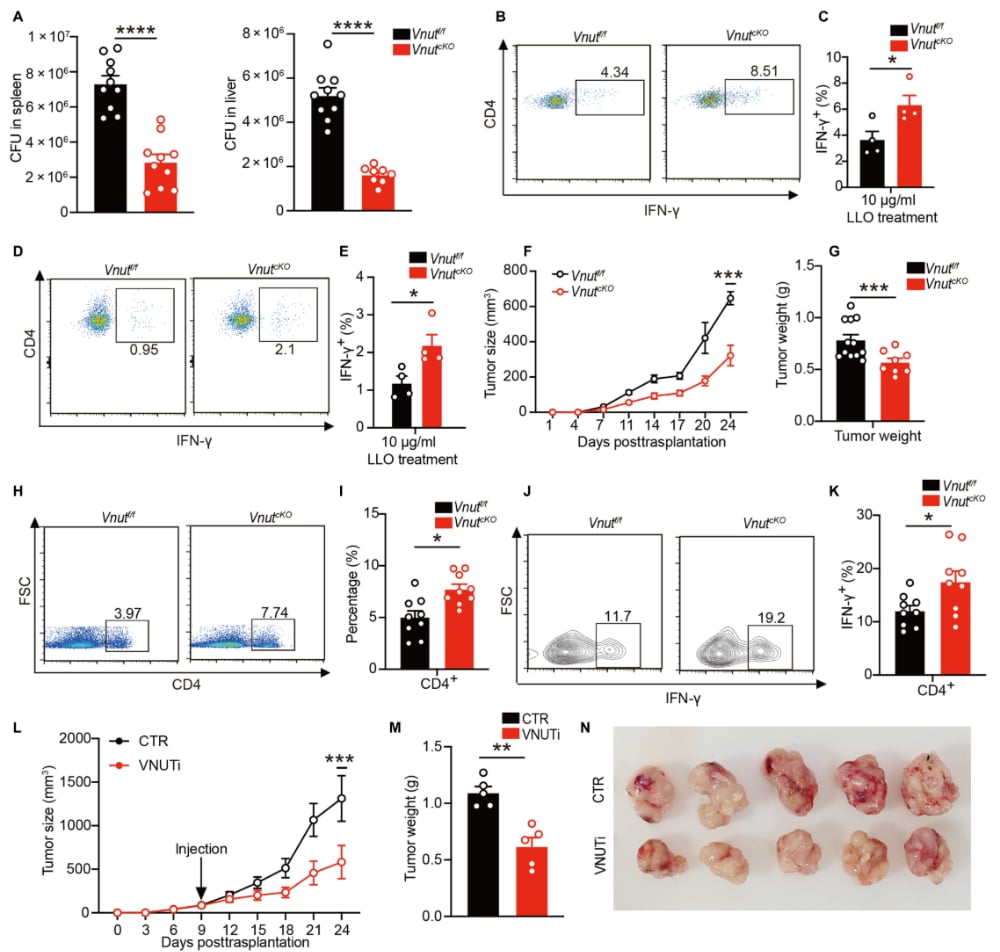
理论机制的发现必须通过功能性实验来验证其临床潜力。研究团队通过构建CD4+ T细胞特异性条件性敲除(cKO)小鼠模型,观察了VNUT缺失对免疫功能的影响。
实验结果显示,无论是通过遗传学手段敲除VNUT,还是通过药理学手段抑制其活性,都能显著增强TH1细胞的效应功能,具体体现在以下两个方面:
1. 增强抗感染能力
在李斯特菌(Listeria)感染模型中,VNUT缺乏的小鼠表现出加速清除病原体的能力。这表明,在需要强大细胞免疫应答的情况下,解除VNUT的抑制作用能够有效地提高机体的防御能力。
2. 限制移植瘤生长
更重要的是,在移植瘤模型中,VNUT敲除显著限制了肿瘤的生长。这提供了直接的证据,证明VNUT是T细胞抗肿瘤免疫的关键负向调节因子。通过解除这一“刹车”,T细胞能够更有效地分化、增殖,并分泌更多的IFN-γ,从而增强对肿瘤的杀伤作用。
这些数据有力地支持了“VNUT是治疗感染和癌症的潜在靶点”这一结论。对于正在寻求癌症治疗方案解读的患者和家属而言,了解这些前沿的免疫机制,有助于理解未来免疫治疗的发展方向。

四、VNUT与现有免疫检查点抑制剂的比较与展望
免疫检查点抑制剂(如PD-1/PD-L1抑制剂)通过解除T细胞表面的抑制信号,彻底改变了癌症治疗格局。VNUT的发现,为免疫检查点领域增添了一个全新的维度。
1. 细胞内检查点的新概念
传统的免疫检查点(如PD-1、CTLA-4)主要位于细胞表面,通过细胞间的相互作用来抑制T细胞。而VNUT的作用机制则发生在细胞内部,通过调控囊泡ATP的转运和释放,影响细胞自身的信号传导。这代表了一种“细胞内检查点”的概念,可能为克服传统检查点抑制剂耐药性提供新的思路。
2. 潜在的联合治疗策略
由于VNUT的作用机制与PD-1等通路不同,理论上,开发VNUT抑制剂可以与现有的免疫检查点抑制剂进行联合治疗,实现协同增效。例如,在对PD-1抑制剂不敏感的“冷肿瘤”中,如果VNUT抑制剂能够有效地增强TH1细胞的浸润和功能,可能会将“冷肿瘤”转化为“热肿瘤”,从而提高整体的治疗响应率。
3. 靶向VNUT的挑战与机遇
尽管VNUT作为靶点潜力巨大,但将其转化为临床药物仍面临挑战。VNUT在多种细胞中表达,且ATP信号传导在全身生理过程中扮演多重角色。因此,开发高选择性、低毒性的VNUT抑制剂,并确保其主要作用于T细胞以增强抗肿瘤免疫,将是未来药物研发的关键方向。
五、FOXO转录因子家族在T细胞分化中的复杂作用
这项研究特别强调了FOXO3a在VNUT信号通路中的作用。FOXO转录因子(如FOXO1和FOXO3)是T细胞分化和功能的重要调控者,它们的作用非常精妙和复杂。
- FOXO1: 已知FOXO1通常抑制TH1细胞分化,通过直接抑制IFN-γ基因的表达来实现。它还促进调节性T细胞(Treg细胞)的生成,这是一种抑制免疫反应的细胞。
- FOXO3a: 在本研究中,VNUT信号通路通过过度磷酸化FOXO3a来影响Eomes的表达,从而抑制TH1细胞功能。然而,在其他背景下,FOXO3a也被认为可以通过上调Eomes来促进致病性TH细胞的分化。这种差异表明,FOXO3a的功能高度依赖于其所处的信号环境和磷酸化状态。
理解VNUT如何精确地调控FOXO3a的磷酸化,是未来设计靶向药物的关键。通过精准调控这一分子开关,有望在不影响其他免疫细胞功能的前提下,特异性地增强抗肿瘤TH1细胞的活性。
六、细胞外ATP(eATP)在肿瘤微环境中的双重角色
细胞外ATP(eATP)在肿瘤微环境中扮演着复杂的双重角色,这使得靶向VNUT的策略更具挑战性,但也更具潜力。
- 作为“危险信号”: eATP是公认的危险信号,可以激活树突状细胞和巨噬细胞,促进炎症反应和免疫细胞募集。
- 作为T细胞抑制剂: 在高浓度或特定信号通路(如本研究中的VNUT-P2X7R轴)下,eATP反而可能通过过度激活P2X7R,导致T细胞功能障碍或细胞凋亡。
这项研究揭示了T细胞自身释放eATP的机制,并证明这种自源性eATP是抑制TH1细胞分化的主要因素。这意味着,通过抑制VNUT,可以减少T细胞周围的抑制性eATP浓度,从而解除对T细胞的负向调控。
七、总结与患者启示:关注前沿研究,探索治疗新选择
清华大学的这项研究为癌症免疫治疗开辟了新的思路,将VNUT确立为限制TH1免疫应答的关键检查点。虽然目前VNUT抑制剂尚处于基础研究阶段,但它代表了未来癌症治疗,尤其是实体瘤免疫治疗的一个重要发展方向。
对于正在与癌症抗争的患者及其家属而言,密切关注这类前沿的临床研究至关重要。了解潜在的新靶点和新机制,有助于在现有标准治疗效果不佳时,探索包括临床试验或海外创新药物获取渠道在内的更多治疗选择。
MedFind致力于追踪全球最新的癌症治疗进展,为患者提供药物信息、治疗方案解读以及国际新药代购与直邮服务。如果您对免疫治疗的最新进展、特定药物的疗效数据或海外用药选择有任何疑问,建议咨询专业的医疗顾问,获取个性化的诊疗建议。