对于晚期癌症患者而言,免疫检查点阻断(ICB)疗法无疑是近年来最令人振奋的治疗进展之一。然而,这种疗法的成功并非普适,它高度依赖于肿瘤自身的生物学特性,其中最关键的指标之一就是错配修复(MMR)状态和肿瘤突变负荷(TMB)。在结直肠癌(CRC)领域,只有少数具有错配修复缺陷(MMRd)的患者能从ICB中获益,而占绝大多数的错配修复功能正常(MMRp结直肠癌)患者,其肿瘤通常表现为免疫“冷”状态,对免疫治疗效果甚微。因此,如何将这些“冷”肿瘤转化为“热”肿瘤,是当前癌症研究的重大挑战。
本文将深度解读一项发表在权威期刊《Cancer Cell》上的临床前研究,该研究提出了一种创新性的联合化疗方案:替莫唑胺(Temozolomide, TMZ)联合顺铂(Cisplatin, CDDP)。研究发现,这种联合用药策略能够诱导MMRp肿瘤发生适应性MMR下调,从而显著增加肿瘤突变负荷和新抗原数量,最终实现有效的免疫控制。对于正在寻找突破性治疗方案的MMRp结直肠癌患者及其家属来说,了解这一机制和临床前数据,对于评估未来的治疗方向至关重要。
MMRp结直肠癌的免疫治疗困境与TMB的重要性
结直肠癌(CRC)是全球常见的恶性肿瘤之一。在治疗策略上,肿瘤的分子特征,尤其是MMR状态,起着决定性作用。MMR系统负责修复DNA复制过程中产生的错误,确保基因组的稳定性。
- MMRd肿瘤(错配修复缺陷):当MMR系统功能缺失时,细胞无法修复DNA损伤,导致基因组高度不稳定,产生大量的DNA突变,即高肿瘤突变负荷(TMB-H)。这些突变会产生大量肿瘤特异性新抗原,使得肿瘤更容易被免疫系统识别。因此,MMRd肿瘤(约占转移性CRC的5%以下)对免疫检查点抑制剂(如PD-1/PD-L1抑制剂)反应极佳,是ICB的经典适应症。
- MMRp肿瘤(错配修复功能正常):这是绝大多数转移性结直肠癌(mCRC)患者的状态。MMRp肿瘤通常具有较低的TMB,产生的免疫原性新抗原较少,免疫细胞浸润不足,被称为免疫“冷”肿瘤。对于这部分患者,传统的ICB单药治疗效果非常有限,亟需新的增敏策略。
细胞毒性化疗一直被视为增加肿瘤免疫原性的潜在策略之一。通过化疗药物诱导DNA损伤,理论上可以增加突变数量,产生新的抗原,从而增强免疫反应。然而,关键在于如何设计化疗方案,使其能够持续且有效地提高TMB,并克服肿瘤对化疗的耐受性。
替莫唑胺与顺铂:化疗药物的“免疫激活”潜力
本研究的核心在于利用两种经典的细胞毒性药物——替莫唑胺和顺铂——的协同作用,来人为地诱导MMRp肿瘤向MMRd表型转变,从而实现免疫增敏。
替莫唑胺(TMZ)的作用机制与限制
替莫唑胺是一种烷化剂,主要通过甲基化DNA来发挥细胞毒性。TMZ诱导的DNA损伤通常由MMR系统识别并试图修复,如果MMR系统正常,则会触发细胞凋亡。然而,TMZ的致突变性(诱导突变的能力)和疗效受到O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)的影响。MGMT是一种修复酶,能够直接修复TMZ诱导的DNA甲基化损伤。在缺乏MGMT的肿瘤中,TMZ的致突变性更强。
此前的ARETHUSA试验曾报告,TMZ治疗MMRp结直肠癌患者,可以通过MMR的适应性失活来增强免疫原性。但这种疗效和TMB升高主要局限于缺乏MGMT表达的mCRC亚组,且诱导的TMB升高多为亚克隆性(即突变只存在于部分肿瘤细胞中),克隆性突变(存在于所有肿瘤细胞中)的增加较少,这限制了其广泛的临床应用。
顺铂(CDDP)的作用机制与MMR关联
顺铂是一种广泛使用的铂类化疗药物,通过形成DNA加合物来阻碍DNA复制和转录,最终导致细胞死亡。顺铂常用于非结直肠癌的消化道恶性肿瘤治疗,并且也被探索与免疫疗法联合使用。
值得注意的是,有研究指出MMR蛋白是CDDP依赖性细胞毒性的介质。肿瘤中MMR的下调或缺失与癌细胞对CDDP的耐受性直接相关。这意味着,如果癌细胞要对CDDP产生耐受,它们可能需要牺牲MMR功能。因此,MMR下调可能构成癌细胞对TMZ和CDDP产生耐受性的共同机制,其代价是细胞出现高度突变。
创新联合策略:TMZ+CDDP诱导高突变性的机制解析
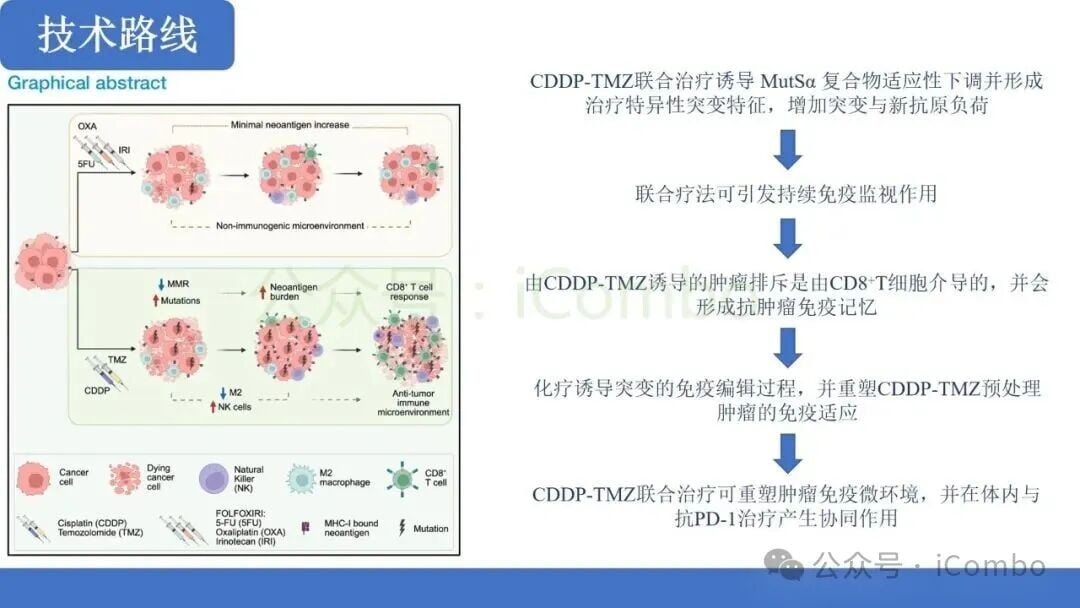
基于上述背景,研究人员假设,将TMZ与CDDP联合使用,可以更有效地迫使MMRp肿瘤细胞进行“适应性进化”,即通过下调MMR功能来同时耐受这两种药物的攻击,从而导致TMB和新抗原的显著增加。
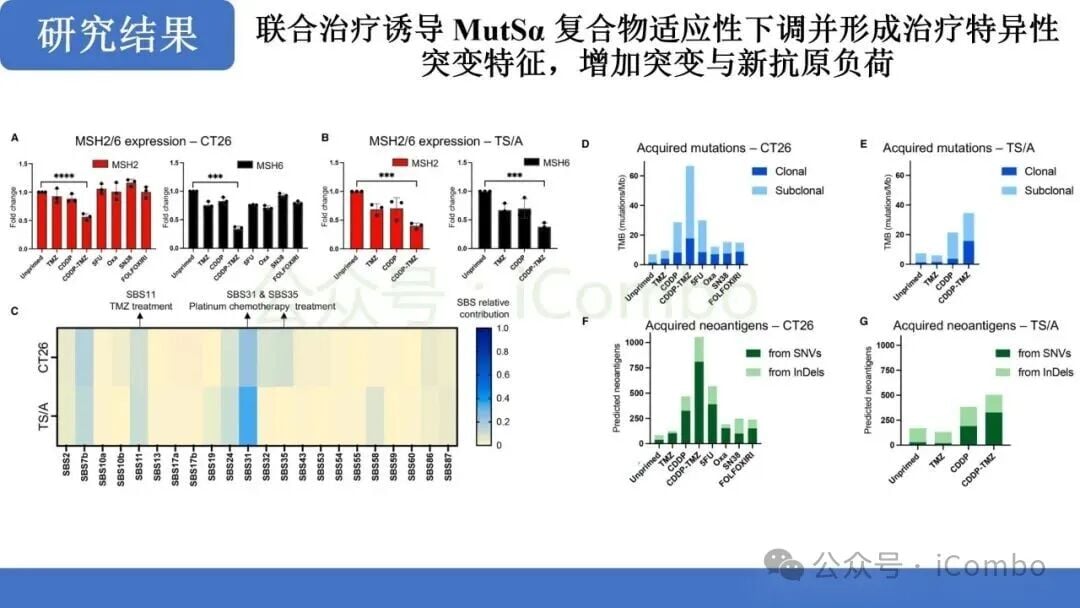
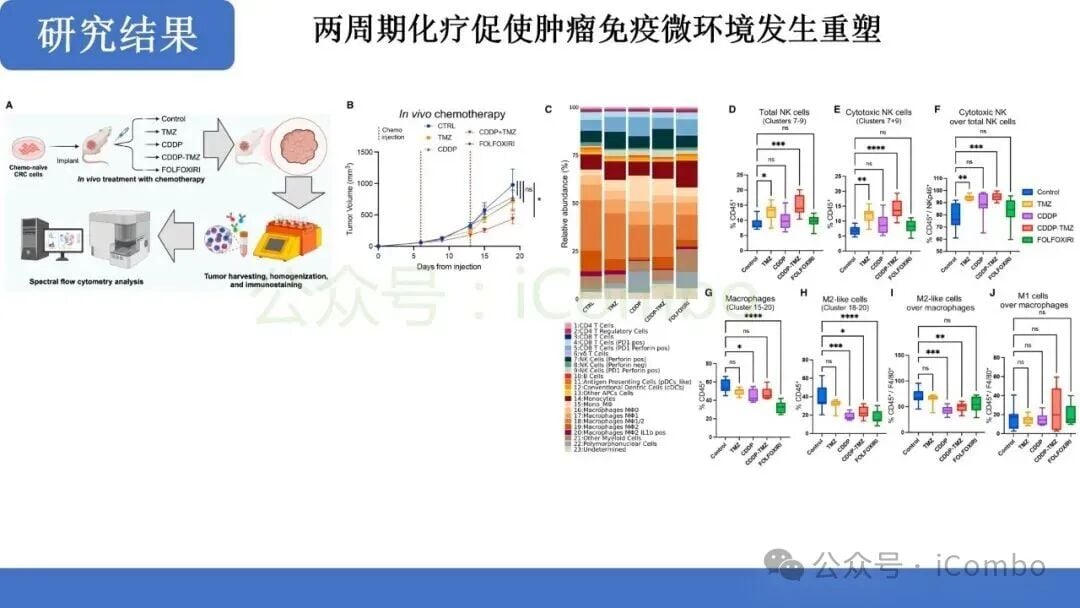
关键发现:适应性MMR下调与TMB激增
在临床前模型中,TMZ与CDDP的联合治疗成功验证了这一假设:
- 诱导MMR适应性下调: 联合治疗显著诱导了MMRp肿瘤细胞中MMR蛋白的适应性下调。这种机制性变化是肿瘤细胞在面对双重DNA损伤压力下,为了生存而付出的“突变代价”。
- 产生独特的超突变特征: 联合治疗产生的突变特征是该治疗特有的,并且与单药TMZ诱导的突变模式不同。重要的是,这种联合治疗不仅增加了亚克隆性高突变,还显著增加了克隆性高突变。克隆性突变存在于肿瘤细胞的大部分群体中,更有可能产生广泛存在的新抗原,从而对免疫系统产生更强的刺激。
- TMB显著提升: 这种适应性MMR下调直接导致了肿瘤突变负荷(TMB)的大幅增加,使得原本“冷”的MMRp肿瘤在分子层面具备了MMRd肿瘤的特征。
研究结果表明,这种联合化疗方案能够有效地将MMRp肿瘤从对免疫治疗不敏感的状态,转化为具有高免疫原性的状态。
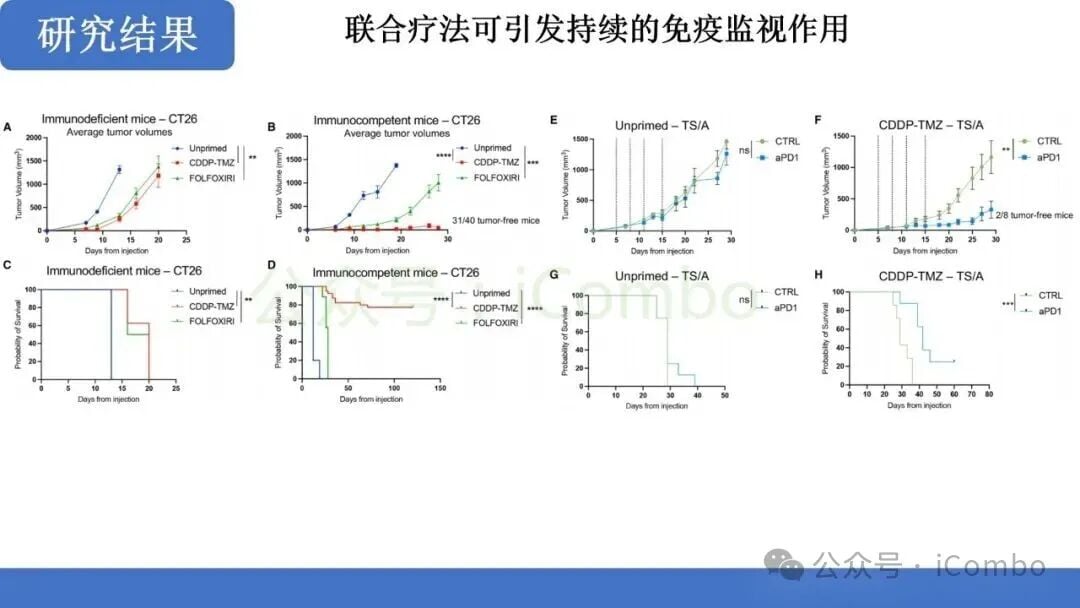
临床前疗效:从“冷”肿瘤到“热”肿瘤的转变
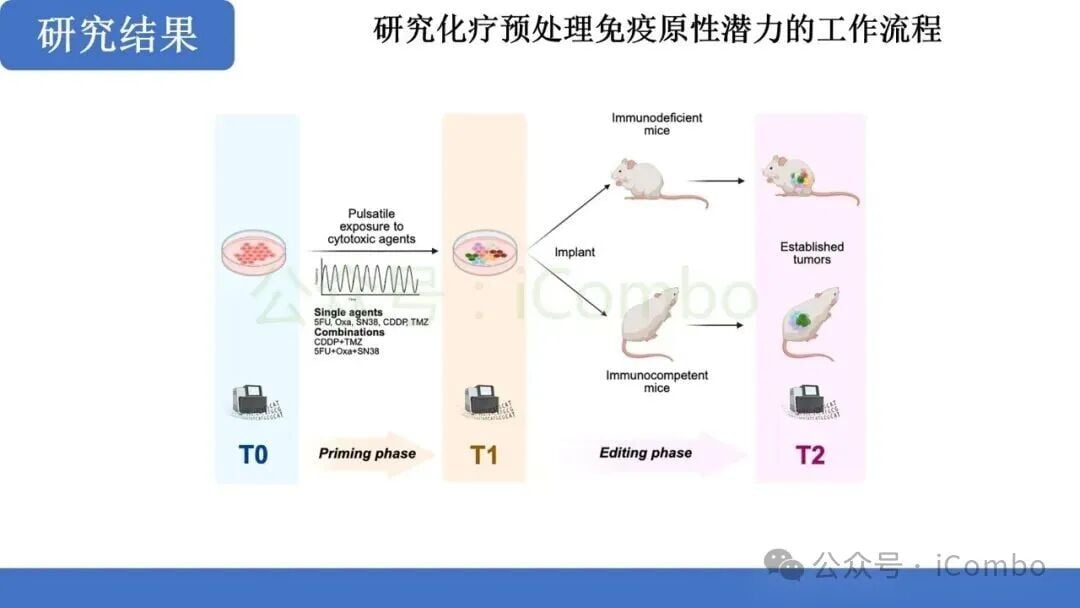
诱导高突变性只是第一步,最终目标是实现对肿瘤的有效免疫控制。研究进一步探索了这种化疗诱导的突变对免疫监视的影响。
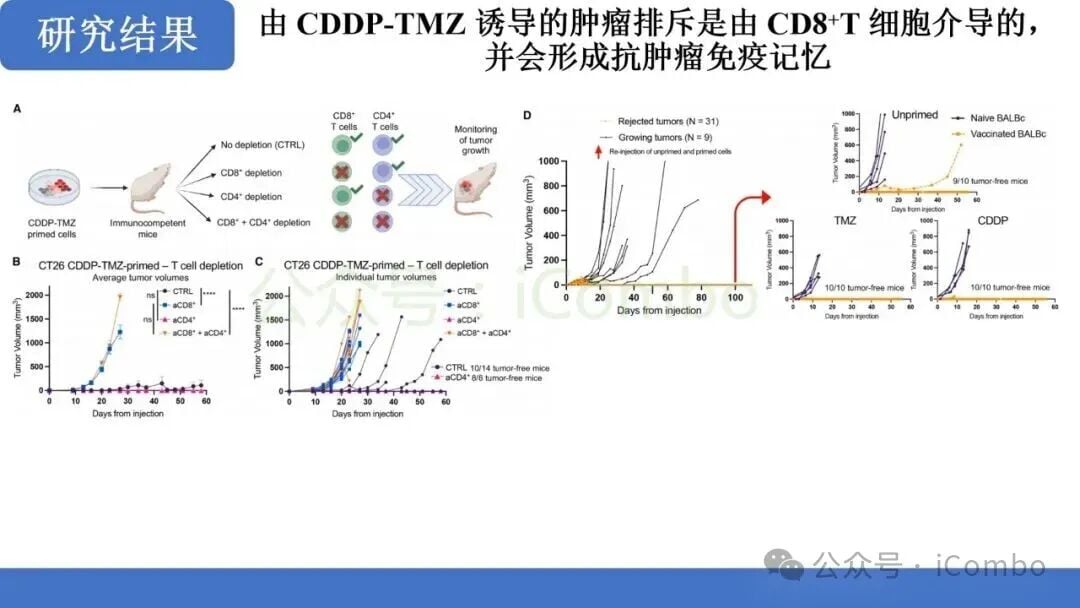
免疫监视的激活与CD8+ T细胞的作用
研究发现,经过CDDP-TMZ预处理的肿瘤,其微环境发生了显著变化,表现出免疫“热”肿瘤的特征:
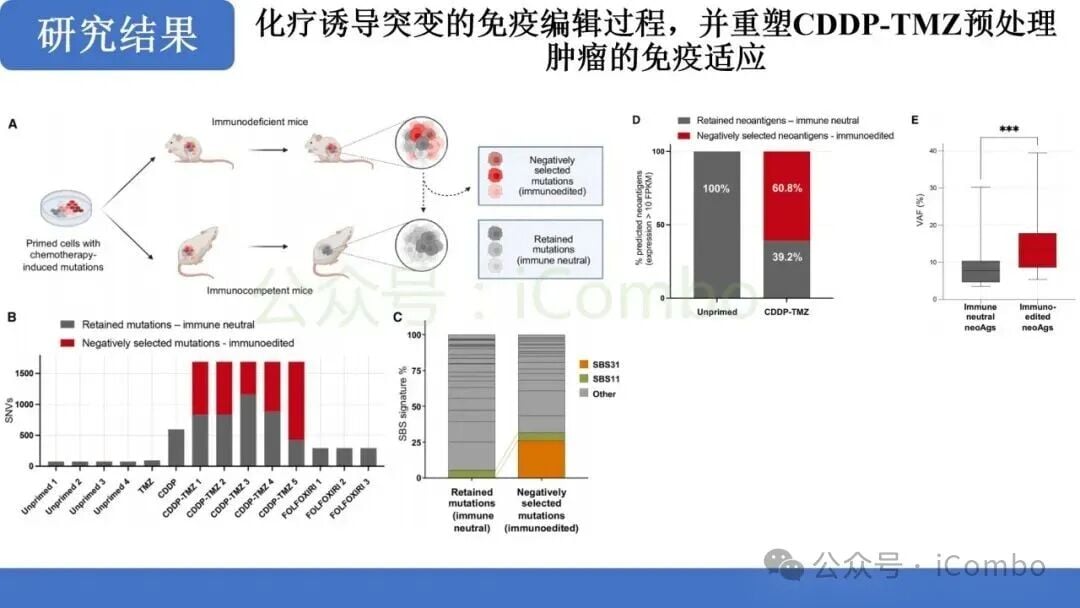
- 新抗原的产生与呈递: 增加的克隆性和亚克隆性突变产生了大量新的肿瘤特异性抗原。这些新抗原被抗原呈递细胞捕获并呈递给T细胞。
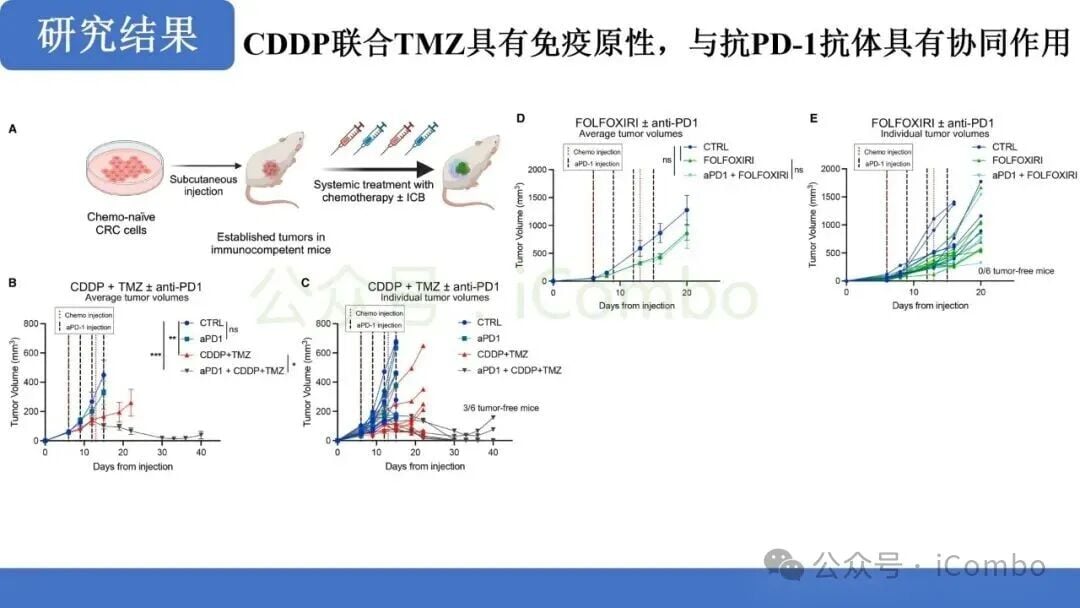
- CD8+ T细胞依赖性免疫编辑: 联合治疗后,肿瘤对免疫检查点抑制剂的敏感性显著提高。研究明确指出,这种免疫控制是以CD8+ T细胞依赖性方式实现的。这意味着,化疗诱导的突变促进了免疫编辑过程,使得CD8+ T细胞能够识别并清除肿瘤细胞。
- 有效的免疫控制: 在动物模型中,联合治疗最终导致了对肿瘤的有效免疫控制,提示了未来与ICB联合治疗的巨大潜力。
这一发现为MMRp结直肠癌的治疗提供了全新的思路:即通过“先化疗诱变,后免疫清除”的两步走策略,克服原发性免疫耐药。




对患者的意义与未来展望
这项临床前研究为MMRp结直肠癌患者带来了新的希望。虽然目前的研究结果主要基于动物模型,但其机制的清晰性——通过诱导MMR适应性下调来实现TMB提升和免疫增敏——为后续的临床转化奠定了坚实的基础。
谁可能受益?
这项联合治疗策略未来一旦进入临床,主要受益人群将是:
- MMRp转移性结直肠癌患者: 特别是那些对传统化疗或靶向治疗效果不佳,且不适合或不响应现有免疫疗法的患者。
- MGMT表达正常的肿瘤: 理论上,由于CDDP的加入,可以绕过TMZ单药治疗中MGMT表达对疗效的限制,使得更广泛的患者群体受益。
临床转化的挑战与方向
将这一策略应用于临床仍需克服挑战,包括确定最佳的给药剂量、时序(是同步还是序贯)、以及评估患者的耐受性和安全性。未来的临床试验将着重于:
- TMZ+CDDP联合ICB: 评估这种“诱变-免疫”联合方案在MMRp CRC患者中的客观缓解率(ORR)和无进展生存期(PFS)。
- 生物标志物的筛选: 寻找除了MMRp状态外,能够预测患者对这种联合方案敏感性的生物标志物。
对于癌症患者及其家属而言,紧密关注这类前沿的临床研究进展至关重要。了解最新的治疗机制和药物组合,有助于在与医生沟通时做出更明智的决策。如果患者需要获取国际前沿的抗癌药物或了解最新的临床试验信息,可以通过专业的海外用药代购与直邮服务来获取所需药物,确保治疗的连续性。
获取创新药物与治疗方案的途径
尽管替莫唑胺和顺铂是临床常用药物,但它们与免疫检查点抑制剂的创新联合方案,以及其他针对难治性癌症的突破性药物,可能尚未在所有国家或地区上市或纳入医保。对于希望第一时间使用国际最新获批药物的患者,了解全球药物信息、治疗方案解读和临床指南是关键的第一步。
MedFind致力于提供权威、及时的医学资讯,并协助患者获取所需的药物。如果您对MMRp结直肠癌的最新治疗方案、药物的价格或购买渠道有任何疑问,可以利用平台提供的AI 辅助问诊服务进行初步咨询,以便更好地规划下一步的治疗路径。