在人类与癌症的漫长抗争中,我们对癌细胞的认识不断深入,从基因突变到表观遗传调控,每一次新发现都为治疗带来了新的曙光。如今,科学的聚光灯正照向一个曾被认为是“暗物质”的领域——表观转录组与RNA修饰。这不仅仅是基因故事的延续,更是基因表达调控的“终极密码”,深刻影响着癌细胞的命运。最近,国际顶级期刊《Cancer Cell》发表了一篇极具前瞻性的综述文章,系统性地揭示了RNA修饰在癌症发生发展中的核心作用、精妙机制及其作为潜在治疗靶点的巨大潜力。这篇重磅综述为我们勾勒出了一幅抗癌新策略的宏伟蓝图,预示着一个全新的靶向治疗时代可能即将到来。MedFind致力于为癌症患者和家属提供前沿抗癌资讯和药物信息,今天我们就来深度解读这篇综述,帮助大家理解这些复杂的科学概念如何转化为未来的治疗希望。

一、什么是表观转录组与RNA修饰?破解生命信息的“密码本”
要理解RNA修饰的重要性,我们首先需要从基因信息的传递过程说起。我们的身体由无数细胞组成,每个细胞都包含一套完整的基因组DNA,DNA就像一本厚厚的“生命设计图”。当细胞需要制造某种蛋白质(例如,维持细胞功能、抵抗疾病的分子机器)时,它会先将DNA上的特定信息“转录”成一种中间分子,这就是RNA(核糖核酸),尤其是信使RNA(mRNA)。mRNA就像是一张从设计图上复印下来的“工作指令单”,它会带着这些指令去细胞内的“工厂”——核糖体,指导蛋白质的合成。
传统观念认为,RNA的序列(即A、U、C、G这四种核苷酸的排列顺序)决定了它携带的信息。然而,科学家们发现,在这个序列之外,RNA分子本身还可以被“化学修饰”,就像在工作指令单上添加了各种“批注”或“高亮标记”。这些化学修饰并不会改变RNA本身的碱基序列,但却能显著影响RNA的命运和功能——例如,它在哪里工作、能存活多久、以及能否被高效地翻译成蛋白质。这些发生在RNA上的可逆化学修饰及其相关调控系统,统称为“表观转录组学”(Epitranscriptomics)。“表观”意味着它们不改变基因序列,却能像DNA表观遗传学(如DNA甲基化、组蛋白修饰)一样,在基因表达层面进行精细调控。
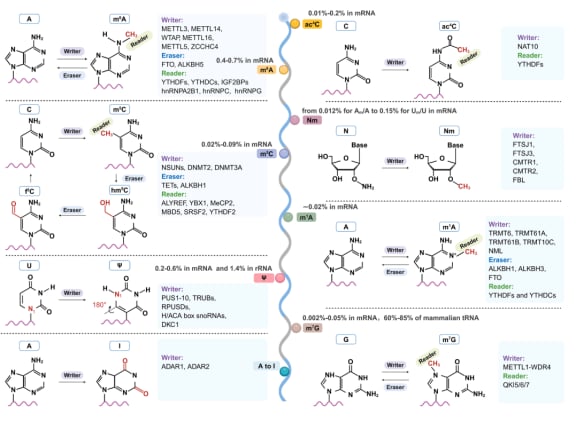
目前,科学家们已经鉴定出超过170种不同的RNA修饰类型,它们分布在信使RNA(mRNA)、转移RNA(tRNA)、核糖体RNA(rRNA)以及各种非编码RNA(如长链非编码RNA lncRNA、环状RNA circRNA)上。其中,研究最深入、与癌症关系最密切的包括:
- N⁶-甲基腺苷(m⁶A):这是真核生物mRNA中最丰富的一种内部修饰,就像是RNA上的一个“通用标记”。它由一个被称为“写入器”(Writers)的酶复合体(如METTL3-METTL14-WTAP)负责安装,就像一个高明的编辑团队在关键信息旁做标记。这些标记可以被“擦除器”(Erasers,如FTO和ALKBH5)移除,也可以被“阅读器”(Readers,如YTHDF1-3、YTHDC1/2、IGF2BP家族、hnRNPs)识别,这些阅读器就像是不同的解读专家,根据标记的存在与否,决定RNA是稳定存在、被降解,还是被翻译成蛋白质。G3BP1/2作为“反读取器”则优先结合未甲基化位点,提示修饰缺失本身亦具调控功能。
- 5-甲基胞嘧啶(m⁵C):这种修饰最初在DNA中发现,后来也在多种RNA中被检测到,尽管丰度低于m⁶A。它主要由NSUN家族(NSUN1-7)和DNA甲基转移酶家族(主要为DNMT2,特定情境下包括DNMT3A)催化。TET家族双加氧酶(如TET2)可氧化m⁵C,而ALKBH1则介导m⁵C的去甲基化。其“阅读器”ALYREF和YBX1则分别介导甲基化mRNA的核输出及胞质稳定性。
- 假尿苷(Ψ):尿苷的C5异构体,广泛存在于rRNA、snRNA、tRNA和mRNA中。它由PUS酶独立催化或DKC1依赖H/ACA向导snoRNA指导修饰。TRUB1修饰线粒体和核编码RNA,RPUSD3/4和TRUB2则介导线粒体翻译及氧化磷酸化。
- 腺苷到肌苷编辑(A-to-I编辑):人类最普遍的RNA修饰,由ADAR1/2酶催化,主要发生在双链RNA(dsRNA)区域。它能影响RNA的剪接、稳定性和蛋白质翻译,甚至能改变蛋白质的氨基酸序列。
- 其他重要修饰:包括由NAT10催化的ac⁴C(增强mRNA稳定性和翻译),2′-O-甲基化(Nm,影响稳定性与蛋白相互作用),m¹A(存在于tRNA、rRNA和mRNA中,功能依赖环境),以及由METTL1-WDR4安装的m⁷G(影响RNA稳定性和翻译)等。
这些“写入器”、“擦除器”和“阅读器”之间相互配合、动态平衡,共同塑造了RNA的“命运”,进而精细调控了细胞的各种生理活动,包括细胞生长、分化、应激反应等。在癌症中,这种精妙的平衡一旦被打破,后果将是灾难性的。
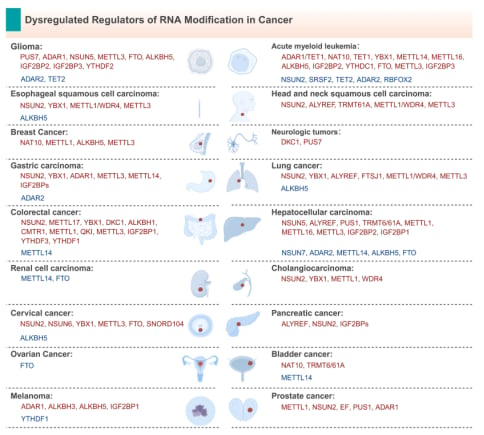
二、RNA修饰如何“助纣为虐”?癌症特征的六大驱动力
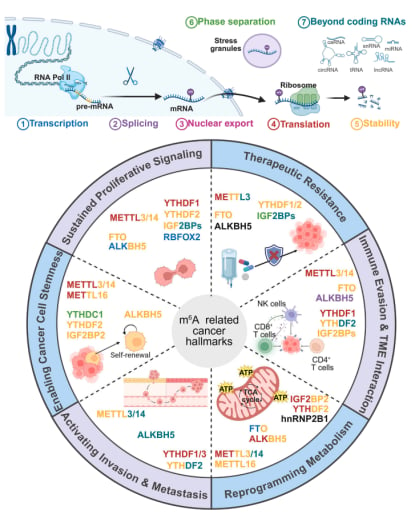
癌细胞之所以难以对付,是因为它们掌握了一系列“超能力”,被称为“癌症的特征”(Hallmarks of Cancer),包括无限增殖、逃避免疫、抵抗凋亡、促血管生成、侵袭转移、重编程代谢等。令人惊讶的是,最新的研究表明,RNA修饰在癌细胞获得并维持这些“超能力”的过程中扮演着关键角色。当RNA修饰的平衡在癌细胞中被打破时,它们就如同被注入了“兴奋剂”,开始疯狂生长,逃避身体的监视。
1. 维持增殖信号和细胞存活:癌细胞永不停止的“加速器”
癌细胞最显著的特征之一就是不受控制地疯狂增殖。它们对生长信号异常敏感,对抑制信号充耳不闻。RNA修饰通过多种方式促进癌细胞的这种“永动模式”:
- m⁶A修饰的“双刃剑”:METTL3/METTL14等m⁶A“写入器”可以给许多促进细胞生长的基因(如MYC、SOX2、EGFR)的mRNA加上m⁶A标记。这些标记被“阅读器”YTHDF1识别后,能促进这些致癌基因的蛋白质翻译,让癌细胞加速分裂。或者被IGF2BP1-3家族阅读器识别并稳定这些mRNA,使它们不容易被降解,从而持续产生促癌蛋白。例如,KRAS、CDK6等重要的癌基因就是这样被调控的。但值得注意的是,m⁶A并非总是“助纣为虐”,在某些情况下,它也可以抑制癌细胞增殖。例如,YTHDF2可以促进EGFR等致癌mRNA的降解,发挥负调控作用。这表明m⁶A对生长的调控具有高度情境依赖性,其效应受细胞类型、突变状态及环境信号的精细塑造。
- “擦除器”FTO和ALKBH5的复杂作用:m⁶A的“擦除器”也参与其中。例如,在急性髓系白血病(AML)和胶质瘤中,FTO通过移除某些致癌基因mRNA(如MYC、CEBPA)上的m⁶A标记,使这些mRNA更稳定,从而促进癌细胞增殖。而在肝细胞癌等中,FTO却可能抑制生长。类似地,ALKBH5在胶质瘤和乳腺癌中促进增殖,却通过降低YAP mRNA的m⁶A水平抑制非小细胞肺癌生长。这些差异凸显了细胞类型、突变状态及环境信号所塑造的谱系特异性调控。
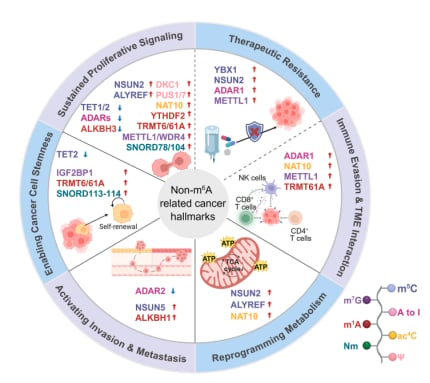
- 非m⁶A修饰的协同作用:其他RNA修饰也 contributes。例如,ALKBH3介导的m¹A去甲基化可破坏肿瘤抑制性PML复合物。METTL1催化的m⁷G修饰能增强tRNA的稳定性,进而促进肝内胆管癌中与增殖相关的基因(如EGFR通路基因)的蛋白质翻译,推动癌症进展。
理解这些精细的调控机制,有助于我们寻找新的靶点,设计出能够“踩刹车”或“切断电源”的抗癌药物。
2. 维持癌症细胞干性:肿瘤“种子”的温床
癌症之所以难以根治,很大一部分原因在于存在一群特殊的癌细胞——癌症干细胞(Cancer Stem Cells, CSC)。它们拥有强大的自我更新能力,能像“种子”一样不断播种新的肿瘤,并且对化疗、放疗等传统治疗方法有很强的抵抗性,是导致肿瘤复发和转移的罪魁祸首。RNA修饰在维持这些“肿瘤种子”的干性上发挥着核心作用:
- m⁶A修饰对CSC的维持:m⁶A修饰对CSC维持至关重要。METTL3通过增加FZD10的m⁶A修饰,能够激活WNT/β-catenin信号通路和YAP1信号,这些都是维持干细胞特性的关键通路。m⁶A去甲基化酶ALKBH5也通过上调TACC3、AXL、NANOG和FOXM1等靶基因,促进AML中的白血病干细胞(LSC)自我更新,并维持胶质母细胞瘤(GBM)和乳腺癌的未分化状态。
- 非m⁶A修饰的参与:其他修饰同样重要。例如,TET2缺陷会导致Tspan13 mRNA的m⁵C修饰增加,使其更稳定,进而激活Tspan13-Cxcr4信号轴,促进LSC归巢、自我更新和白血病的发生发展。tRNA的m¹A甲基转移酶TRMT6/TRMT61A通过促进PPARδ的翻译,增强胆固醇生物合成和Hedgehog信号,从而支持肝脏CSC的自我更新。此外,Nm修饰与其他RNA标记协同调控CSC相关翻译;在肝细胞癌(HCC)中,m⁶A驱动的MIR4435-2HG稳定NOP58,降低rRNA 2′-O-甲基化水平,促进IRES依赖性致癌基因翻译,强化CSC特性。
这表明,靶向RNA修饰有望清除这些顽固的“肿瘤种子”,从根本上减少肿瘤复发的可能性。
3. 激活肿瘤侵袭和转移:癌细胞的“迁徙之旅”
肿瘤转移是癌症致死的主要原因。当癌细胞从原发部位脱离,侵入周围组织,并通过血液或淋巴系统扩散到远处器官时,疾病就进入了晚期。RNA修饰在驱动癌细胞的这种“迁徙之旅”中扮演着关键角色:
- m⁶A修饰的复杂调控:在结直肠癌、胃癌、肺癌、乳腺癌和肝癌中,METTL3通过调控HDGF、ZMYM1等促转移靶基因的m⁶A修饰,以及影响MAPK信号通路和YTHDF2-SOCS2通路,促进癌细胞发生上皮-间质转化(EMT,这是细胞获得侵袭能力的关键步骤)、侵袭和转移定植。然而,有趣的现象是,METTL14在肝细胞癌、结直肠癌、肾癌和膀胱癌中却表现出抑制转移的作用,它通过下调SOX4、ARRDC4、Notch1等促转移mRNA,并促进肿瘤抑制性miRNA加工,其作用差异可能源于METTL3的METTL14非依赖性功能或情境特异性调控。
- 非编码RNA与m⁶A修饰:一些非编码RNA(如circNSUN2、circ-YAP、NEAT1、XIST等)的促转移功能也常常依赖于m⁶A修饰。例如,circNSUN2通过IGF2BP2依赖性地稳定HMGA2,促进结直肠癌肝转移;circ-YAP经YTHDF3增加YAP衍生肽驱动肿瘤播散。METTL14甲基化的NEAT1和XIST经YTHDF2介导降解,其缺失导致RNA积累并促进肾癌和结直肠癌转移。在三阴性乳腺癌中,去甲基化的LINC00115能逃避YTHDF2依赖性降解,进而激活HIF1α信号,驱动肿瘤细胞的化疗抗性播散。
- 其他RNA修饰的参与:非m⁶A修饰也参与转移调控。例如,NSUN5能结合SMAD3启动子,增强其染色质可及性和转录,激活EMT,从而促进肝细胞癌进展。miR-589-3p的A-to-I编辑将其靶标从PCDH9重定向至促侵袭ADAM12,体现RNA编辑的情境依赖性作用。ALKBH1通过对METTL3 mRNA的去甲基化,促进结直肠癌的EMT和转移。
通过深入理解这些机制,我们有望开发出能阻止癌细胞“远行”的治疗方法。
4. 重编程癌症代谢:癌细胞的“能量工厂”
癌细胞为了快速增殖,会像一个高效的“能量工厂”一样,重编程自身的代谢模式,例如优先进行有氧糖酵解(即“瓦尔堡效应”),并调整脂质和氨基酸的代谢,以适应营养匮乏和缺氧的微环境。RNA修饰在调控这种代谢可塑性方面起着关键作用:
- 糖酵解的调控:癌细胞优先采用有氧糖酵解以支持合成代谢生长。METTL3通过调控HK2、SLC2A1、ENO2等限速酶在多种癌症中促进糖酵解;METTL14则呈情境依赖性,在胃癌中增强糖酵解,但在肝细胞癌(HCC)和肾癌中抑制糖酵解。FTO在白血病及实体瘤中促进糖酵解,却抑制肺腺癌中m⁶A依赖性MYC翻译;ALKBH5促进乳腺癌糖酵解,但在宫颈癌和肝癌中促进氧化磷酸化。
- 脂质和氨基酸代谢的重塑:在肝细胞癌中,METTL3稳定lncRNA LINC00958以上调脂质生成酶(如FASN、ACC1);在结直肠癌中,METTL3通过上调POU6F2-AS1招募YBX1激活FASN。代谢物NADP可激活FTO酶活性,增强m⁶A去甲基化并促进脂肪生成。相反,ALKBH5在食管癌中下调ACLY和ACC1抑制脂肪酸合成。在急性髓系白血病(AML)中,METTL3/METTL14通过IGF2BP2增强MYC、GPT2及转运蛋白SLC1A5的稳定性,维持白血病增殖及白血病干细胞自我更新。METTL16在AML中促进BCAT1/2 m⁶A修饰以增强支链氨基酸分解代谢;IGF2BP3稳定PHGDH和PSAT1强化丝氨酸驱动的核苷酸合成。非m⁶A修饰中,PUS7在MYCN扩增神经母细胞瘤中驱动代谢重编程;NSUN2在骨肉瘤中稳定FABP5 mRNA促进脂解;NAT10在三阴性乳腺癌(TNBC)中通过ac⁴C修饰上调JunB和LDHA增强糖酵解,并促进SLC1A4、HOXA9翻译以驱动丝氨酸摄取。
针对癌细胞代谢的靶向治疗一直是热点,RNA修饰为我们提供了更深层次的干预点。
5. 免疫逃逸和微环境相互作用:癌细胞的“隐身衣”
免疫系统是身体对抗疾病的强大防线,但癌细胞却非常狡猾,它们会穿上“隐身衣”,逃避免疫系统的监视和攻击,甚至能“策反”免疫细胞,使其成为助纣为虐的帮凶。RNA修饰在塑造这种免疫逃逸和建立免疫抑制性微环境中扮演着至关重要的角色:
- m⁶A调控免疫检查点和抗原呈递:免疫检查点分子(如PD-L1)是癌细胞逃避免疫攻击的重要手段。在急性髓系白血病(AML)中,FTO通过促进PD-L1、PD-L2和LILRB4的m⁶A依赖性上调,支持癌细胞的免疫逃逸和疾病进展。在黑色素瘤中,抑制ALKBH5能增强抗PD-1疗法的效果。这提示我们,靶向这些RNA修饰调控因子,有望解除癌细胞的“隐身衣”,让免疫系统重新识别并攻击肿瘤。m⁶A还影响抗原呈递和干扰素(IFN)信号。在AML中,METTL3和IGF2BP3稳定CD47和LGALS9,这会损害T细胞和自然杀伤(NK)细胞对癌细胞的识别。此外,m⁶A还会塑造IFN信号:METTL3/METTL14甲基化IFNB1 mRNA以进行YTHDF2介导的降解,该通路的缺失稳定IFNB1并提高IFN-β产生,从而削弱了适应性抗肿瘤免疫。
- 非m⁶A修饰的免疫调节潜力:其他RNA修饰同样具有免疫调节功能。例如,体外转录mRNA中的假尿苷(Ψ)被证明能抑制先天免疫触发。ADAR1介导的A-to-I编辑能维持先天免疫耐受,其缺失会减少IFN刺激的dsRNA的编辑,触发MDA5激活,提高I型IFN,并增强黑色素瘤中的抗肿瘤免疫,从而使肿瘤对PD-1阻断敏感,并克服抵抗。但另一方面,ADAR1也可以驱动免疫逃逸:通过编辑DDX58,它诱导PTIR1,进而募集去泛素化酶UCHL5来抑制免疫蛋白酶体活性,损害新抗原加工,并阻断T细胞识别,促进免疫治疗抵抗。
这些发现为我们理解免疫治疗耐药性提供了新的视角,并为开发新型免疫增敏剂指明了方向。
6. 影响药物敏感性和治疗抵抗:癌细胞的“坚固防线”
治疗抵抗是癌症治疗面临的最大挑战之一,它常常导致肿瘤复发、转移和治疗失败。RNA修饰通过精细调控DNA修复、细胞凋亡、代谢和免疫逃逸等通路,在决定癌细胞对化疗、放疗、靶向治疗和免疫治疗的反应中发挥着关键作用,构筑起癌细胞的“坚固防线”:
- m⁶A与治疗抵抗:作为主要的m⁶A“写入器”,METTL3在多种癌症中促进治疗抵抗。例如,在胶质瘤干细胞(GSC)中,它甲基化并稳定SOX2 mRNA,增强DNA修复能力,从而促进放射抵抗。METTL3在结直肠癌中增强LDHA翻译,支持癌细胞对5-氟尿嘧啶(5-FU)的糖酵解依赖性抵抗。在肝细胞癌中,它甲基化FZD10 mRNA,促进对乐伐替尼的抵抗。
- “擦除器”FTO和ALKBH5的反向调控:m⁶A的“擦除器”也参与抵抗。例如,在AML中,R-2-羟基戊二酸(R-2HG)抑制FTO活性,会增加m⁶A水平并去稳定致癌转录本,从而使白血病细胞对全反式维甲酸(ATRA)、5-氮杂胞苷、地西他滨和柔红霉素等传统化疗药物敏感。m⁶A修饰的非编码RNA也驱动抵抗,在卵巢癌中,circPLPP4被m⁶A稳定并作为miR-136的海绵,导致PIK3R1表达增加和顺铂敏感性降低。
- 非m⁶A修饰与治疗抵抗:其他RNA修饰同样塑造治疗抵抗。例如,NSUN2驱动的m⁵C甲基化,包括稳定TREX2 mRNA,可以限制细胞质dsDNA的积累,抑制cGAS-STING信号,并在PD-L1阻断下促进免疫逃逸。
RNA修饰通过这些复杂机制,帮助癌细胞躲避各种治疗的打击,这使得靶向RNA修饰成为逆转耐药、提高现有治疗效果的重要方向。
三、RNA修饰世界的“合纵连横”:复杂调控网络的揭示
RNA修饰并非孤立地发挥作用,它们在细胞内部形成了一个巨大的、相互关联的调控网络,就像一个复杂的神经网络。不同的RNA修饰之间,以及RNA修饰与染色质/DNA调控之间,存在着精妙的“串扰”(Crosstalk),共同影响着癌细胞的行为。理解这些“合纵连横”的机制,对于我们全面认识癌症的复杂性至关重要。
1. 不同RNA修饰之间的“串扰”
想象一下,不同的RNA修饰就像是RNA分子上打的各种不同颜色、不同形状的标记。这些标记之间可能相互影响,共同决定RNA的最终命运:
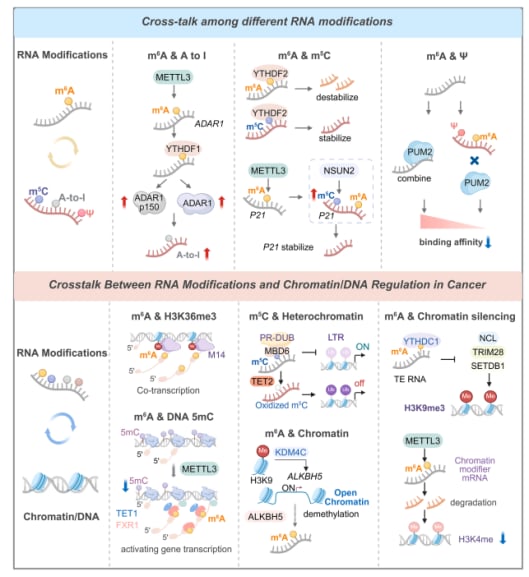
- m⁶A与A-to-I编辑的相互作用:这两种修饰之间的关系非常微妙且具有情境依赖性。在正常细胞中,m⁶A有时通过破坏ADAR1识别所需的dsRNA结构来抑制A-to-I编辑。但在胶质母细胞瘤(GBM)中,METTL3介导的ADAR1 mRNA的m⁶A修饰,却能被YTHDF1识别并促进其翻译,增强干扰素诱导的ADAR1p150表达,进而影响先天免疫调节。
- m⁶A与m⁵C的协同作用:在肿瘤相关通路中,m⁶A和m⁵C常常协同作用。例如,METTL3介导的p21 mRNA的m⁶A修饰,可以促进其附近NSUN2催化的m⁵C修饰。这种“双重标记”的mRNA在细胞应激状态下,稳定性更强,翻译效率也更高。此外,许多m⁶A效应因子(如METTL14、WTAP、YTHDF2)与m⁵C调控因子(如NSUN4、ALYREF、YBX1)在癌细胞中常常同时高表达,共同调控线粒体代谢、翻译等关键的肿瘤适应性通路。YTHDF2甚至可以作为“核心节点”,整合不同修饰信号,在B细胞恶性肿瘤中,其作为m⁶A阅读器去稳定免疫相关转录本,而作为m⁵C阅读器稳定线粒体ATP酶组分mRNA以支持肿瘤代谢。单分子定位证实m⁶A与m⁵C常共存于同一转录本。
- m⁶A与假尿苷(Ψ)的结构效应:m⁶A倾向于让RNA局部解旋,而假尿苷(Ψ)则能稳定碱基堆积。这两种修饰共存时,可以通过相反的结构效应进一步削弱某些RNA结合蛋白(RBP,如PUM2)的结合,并对mRNA翻译产生分层影响。
这些相互依赖性揭示了癌细胞如何利用RNA修饰的微调功能,来响应环境变化并维持其恶性适应性。
2. RNA修饰与染色质/DNA调控之间的“串扰”
不仅RNA修饰之间有“对话”,RNA修饰还能与更深层次的基因组调控(即DNA和组蛋白的表观遗传修饰)进行“双向沟通”。这就像指令单上的批注,不仅影响指令的执行,还能反过来影响设计图本身的解读。
- 染色质特征指导RNA修饰:DNA被紧密缠绕在组蛋白上形成染色质。染色质的开放或紧密程度会影响基因的表达。研究发现,某些组蛋白修饰(如H3K36me3)可以被METTL14识别,进而促进m⁶A在pre-mRNA外显子和3’UTR上的安装,将活跃的染色质状态与mRNA的稳定性联系起来。此外,组蛋白去甲基化酶KDM4C在AML中可以重塑ALKBH5位点的染色质,上调这个m⁶A“擦除器”,从而稳定AXL等致癌转录本,维持白血病干细胞的特性。
- 修饰RNA反向调控染色质:令人惊叹的是,被修饰的RNA也能反过来影响染色质。例如,FXR1可以招募TET1到m⁶A标记的RNA上,介导位点特异性的DNA去甲基化,从而导致染色质的开放,促进相关基因的表达。YTHDC2结合m⁶A修饰的HERVH RNA,以维持DNA的低甲基化。TET2氧化逆转录转座子RNA上的m⁵C,经MBD6募集去泛素化酶去除H2AK119ub促进染色质去抑制;而m⁶A标记的LINE1等重复RNA则招募YTHDC1,支架SETDB1/TRIM28沉积H3K9me3以强化沉默。
- RNA修饰调控染色质修饰因子:RNA修饰还可以通过调节编码染色质修饰因子的mRNA来间接影响染色质。例如,METTL3介导的m⁶A可以促进组蛋白甲基转移酶mRNA降解,其缺失会导致H3K4甲基化增加并破坏基因表达。CFL1作为METTL3辅因子,增强超增强子RNA m⁶A,招募YTHDC2/MLL1促进H3K4me3,增加染色质可及性以驱动胰腺导管腺癌致癌转录。
这些复杂的相互作用揭示了癌细胞如何巧妙地整合多层面的调控机制,来维持其干性、促进肿瘤进展和适应环境变化。深入理解这些机制将为我们提供更全面的抗癌策略。
四、单细胞与空间异质性:肿瘤的“千人千面”
“千人千面”是肿瘤的显著特点,即使是同一个肿瘤内的癌细胞,也可能表现出巨大的差异。这种异质性是导致治疗失败、肿瘤复发和转移的重要原因。传统的bulk(整体)样本分析往往会掩盖这些细胞间的细微差异。而最新的单细胞和空间分析技术,则像“高清显微镜”一样,揭示了RNA修饰在肿瘤内部的广泛异质性,为我们理解肿瘤的复杂性打开了新的大门。
- 单细胞层面RNA修饰的差异:科学家们利用先进的单细胞m⁶A定位技术(如scDART-seq),发现即使在同一组织内部,不同细胞之间的m⁶A和A-to-I等RNA修饰标记也存在显著差异。这意味着,有些细胞可能某种RNA修饰水平很高,而另一些细胞则很低,这种细胞特异性的RNA修饰模式甚至独立于转录本的丰度。例如,某些低丰度的位点在特定的癌细胞亚群中可能被高度修饰,这种异质性可能正是肿瘤能够实现谱系可塑性、环境适应性以及抵抗治疗的关键。它解释了为什么某些癌细胞能对药物产生抵抗,而其他细胞却不能。尽管现有方法依赖工程化读取器-编辑器融合,限制了其在原代样品中的应用,并面临背景噪声、RNA可及性及m⁵C/Ψ检测受限等挑战,但计算框架SigRM等正改进单细胞m⁶A检测,可推断细胞类型特异性甲基化轨迹。
- 空间分辨率下的RNA修饰分布:除了单细胞层面的异质性,RNA修饰在肿瘤组织内部的空间分布也呈现出独特的模式。空间表观转录组学技术能够让我们看到,在肿瘤的不同区域,比如肿瘤中心、边缘或者转移灶,RNA修饰的模式可能完全不同。例如,在三阴性乳腺癌(TNBC)中,通过Select-seq技术定位A-to-I编辑,发现癌症干细胞(CSC)富集区域的GPX4编辑水平升高,这与铁死亡抵抗和不良预后相关。这凸显了空间RNA修饰模式在临床上的重要意义,因为它可能揭示肿瘤内部的局部脆弱性或抵抗性区域。然而,RNA降解、低通量及读数准确性等限制仍制约罕见事件的检测。
虽然单细胞和空间表观转录组学技术仍面临一些挑战,但随着技术的不断进步,我们对RNA修饰与细胞状态、肿瘤演变轨迹以及肿瘤微环境之间复杂关联的理解将日益清晰。将高分辨率的表观转录组图谱与蛋白质组学、表观基因组学及空间染色质图谱等多维度数据整合,将是未来深入解析癌细胞身份、发现肿瘤内异质性,并揭示情境特异性治疗靶点的关键。
五、曙光已现:RNA修饰的治疗前景与挑战
鉴于RNA修饰在癌症生物学中的核心作用,科学家们正积极将其转化为实际的治疗策略。由于RNA修饰的动态性和可逆性,它们提供了一个可“编程”的干预层面,其调控机制——包括“写入器”、“擦除器”、“阅读器”以及相关的辅因子——都成为精准肿瘤学极具吸引力的切入点。这预示着抗癌治疗可能即将迎来一个颠覆性的新时代。
1. 靶向m⁶A调控因子:最具潜力的突破口
目前,针对失调的m⁶A调节因子的小分子抑制剂研发进展最为迅速:
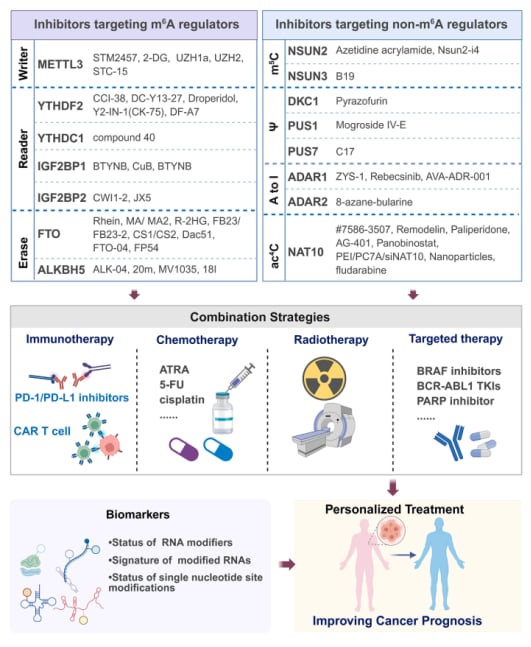
- FTO抑制剂:FTO作为m⁶A的“擦除器”,在急性髓系白血病(AML)、胶质母细胞瘤(GBM)和肺癌中表现出重要的促癌作用。早期的FTO抑制剂,如Rhein和甲氯芬那酸,在临床前研究中能够恢复m⁶A甲基化水平并抑制癌细胞的增殖。后续开发的化合物,如FB23-2、CS1和CS2,进一步提高了选择性和代谢稳定性。这些进展为针对FTO开发新型抗癌药物奠定了基础。
- METTL3抑制剂:METTL3作为m⁶A“写入器”的核心催化亚基,也是一个重要的靶点。工具化合物STM2457在临床前模型中显示出有前景的抗白血病活性,且毒性较小。更令人振奋的是,首个针对METTL3的抑制剂STC-15已经进入I期人体临床试验,并已报告了初步的药代动力学/药效学(PK/PD)和活性数据,这标志着RNA修饰靶向治疗迈出了从实验室到患者的关键一步。
- 靶向m⁶A阅读器:除了写入器和擦除器,靶向m⁶A“阅读器”也日益成为癌症和免疫调节领域有前景的治疗策略。通过干扰癌细胞解读m⁶A标记的能力,可以阻断其致癌信号通路。
2. 靶向非m⁶A调控因子:多元化的治疗策略
除了m⁶A,其他RNA修饰的调控因子也逐渐成为新的靶点:
- NSUN2抑制剂:鉴于m⁵C“写入器”NSUN2在癌症中的关键作用,针对它的抑制剂研发也备受关注。科学家已经鉴定出一种立体选择性共价NSUN2抑制剂——氮杂环丁烷丙烯酰胺,它能阻断tRNA结合,降低m⁵C水平并抑制肿瘤进展。另一款小分子抑制剂Nsun2-i4在结直肠癌中显示出抑制肿瘤进展的作用,并展现出良好的安全性和与PD-1抑制剂的协同作用。
- 假尿苷化酶抑制剂:针对假尿苷化酶的抑制剂也逐渐被表征。例如,Mogroside IV-E被鉴定为特异性PUS1抑制剂,通过降低PUS1表达,对前列腺癌表现出强大的抗转移作用。化合物C17是PUS7的化学抑制剂,可以防止PUS7介导的假尿苷化并抑制肿瘤发生。此外,DKC1抑制剂(吡唑呋喃)和曲美替尼(MEK抑制剂)的组合已被证明协同抑制结直肠癌细胞的生长。
这些早期发现表明,靶向不同的RNA修饰酶,可以为癌症患者提供更加多元化和精准的治疗选择。
3. 联合策略:增强治疗效果,克服耐药性
单一靶向RNA修饰可能难以完全根除肿瘤。因此,将RNA修饰靶向药物作为“增敏剂”,与其他传统或新型疗法(如免疫治疗、化疗、放疗、靶向治疗)联合使用,是当前最具前景的策略之一。这种联合疗法通过破坏肿瘤的耐药回路,有望显著增强治疗效果并克服耐药性:
- 与免疫治疗结合:FTO抑制剂(如CS1、CS2、Dac51)和ALKBH5抑制剂(如ALK-04)在AML、肺癌和黑色素瘤中,被发现能够与T细胞疗法或PD-1/PD-L1抑制剂协同作用,增强抗肿瘤免疫反应。YTHDF2抑制剂CCI-38可以恢复癌细胞表面的CD19和MHC-II表达,增强CAR-T细胞疗法对肿瘤的杀伤效果。
- 克服化疗耐药:FTO抑制(通过遗传学手段或R-2HG药物)可以使AML和胶质瘤对ATRA、阿扎胞苷等药物重新敏感。降低METTL3表达(基因敲低)能使胰腺癌对顺铂和5-氟尿嘧啶(5-FU)敏感。YTHDF2抑制剂droperidol能够逆转紫杉醇耐药。
- 增强放疗效果:METTL3通过稳定H2AX、SOX2等转录本,介导非小细胞肺癌和胶质瘤的放射抵抗。而ALKBH5和FTO通过染色质重编程促进照射后癌细胞存活;YTHDF2抑制剂DC-Y13-27靶向MDSC增强放射敏感性。
- 提高靶向治疗疗效:METTL3促进EGFR翻译,可能增强黑色素瘤对BRAF抑制剂的耐药性。FTO驱动慢性髓系白血病(CML)对BCR-ABL1酪氨酸激酶抑制剂(TKI)的适应性耐药。此外,FTO和ALKBH5的耗竭也可能通过FZD10高甲基化,降低PARP抑制剂的疗效。
这些联合策略为我们提供了更强大的武器,有望打破癌细胞的“坚固防线”,为患者带来更持久的治疗应答。未来的研究将探索跨表观转录组的双重靶向,例如m⁶A与A-to-I联合、写入器与阅读器共抑制,或m⁶A与m⁷G联合等多种组合模式,并密切关注药效学生物标志物及安全性监测。
4. 新兴技术和生物标志物潜力:精准医疗的未来
除了药物研发,RNA修饰的调控逻辑还被应用于诊断创新和精准干预。科学家们正努力利用RNA标记的序列特异性和动态性质,来改善癌症的诊断、分类、治疗设计和疾病监测。
- 表观转录组编辑:虽然仍处于早期概念阶段,但CRISPR-Cas13等基因编辑工具和可编程RNA修饰“写入器”或“擦除器”已被提出,用于选择性编辑靶向转录本上的特定标记。这提供了一种在不改变基因组的情况下进行转录后治疗控制的途径,具有巨大的想象空间。
- m⁶A及其调控因子作为生物标志物:m⁶A的前景以及METTL3、FTO和IGF2BP的表达水平,已与多种癌症的预后、复发风险和治疗反应相关。例如,m⁶A的差异修饰可以将胰腺导管腺癌(PDAC)患者分为具有不同预后结局的两种亚型。近期研究还表明,肿瘤特异性m⁶A模式与肺腺癌和前列腺癌的疾病侵袭性和预后相关,进一步强调了m⁶A失调作为临床信息生物标志物的潜力。
这些进展突显了m⁶A机制作为连接RNA生物学与临床应用的可编程层的潜力。随着这些技术的成熟,RNA修饰引导的策略可能成为个性化、以RNA为中心的癌症护理的重要工具。MedFind将持续关注这些前沿研究的进展,并致力于将其中的最新发现转化为患者可及的治疗方案,助力更多患者重获健康。
六、结语与MedFind的承诺
RNA修饰,这些曾经不为人知的“基因批注”,正以前所未有的深度和广度,重塑我们对癌症生物学的理解。它们不再是简单的分子标签,而是癌症发生发展、转移扩散、免疫逃逸和治疗抵抗背后的关键调控者。从无限增殖到干细胞特性,从代谢重编程到药物敏感性,RNA修饰几乎影响着癌细胞的每一个“超能力”。
这份《Cancer Cell》综述为我们描绘了一个充满希望的未来:靶向RNA修饰的“写入器”、“擦除器”和“阅读器”,有望开发出全新的抗癌药物,甚至能够作为“增敏剂”,与现有疗法强强联合,打破癌细胞的防线,克服耐药性。虽然目前许多针对RNA修饰的药物仍处于临床前或早期临床阶段,但其展示出的巨大潜力,无疑为众多癌症患者点亮了新的希望之光。
然而,将这些前沿科学发现转化为临床实践,仍面临诸多挑战,包括药物的特异性、安全性、以及如何将复杂的修饰机制精确应用于个性化治疗。解决这些挑战需要跨学科的努力,结合结构生物学、单细胞和空间表观转录组学、蛋白质组学以及高通量筛选等先进技术。
作为癌症患者和家属的同行者,MedFind深知每一份希望对您的重要性。我们将持续追踪全球最新的抗癌研究进展和药物研发动态,为您提供权威、及时、易懂的资讯解读。如果您对最新的抗癌药物研发进展感兴趣,或希望了解更多创新治疗方案,请随时联系MedFind专业团队。我们将为您提供前沿资讯和购药渠道支持,助您把握每一个治疗希望,勇敢前行。
参考文献
Deng X, Wu D, Zhao Y, Qing Y, Wu H, Chen J. Epitranscriptomic control of cancer hallmarks: Functions, mechanisms, and therapeutics of RNA modifications. Cancer Cell. 2026 Jan 12;44(1):50-76. doi: 10.1016/j.ccell.2025.12.001.