常见药物与癌症精准治疗:潜在的冲突与突破
随着癌症治疗进入精准医学时代,靶向疗法和创新基因编辑技术(如CRISPR-Cas9)为患者带来了新的希望。然而,许多癌症患者在接受这些高度特异性治疗的同时,往往也在服用针对慢性病或感染的常规药物。这些看似无关的日常药物,是否会对复杂的抗癌过程产生影响?一项由马克斯-普朗克进化人类学研究所科学家主导的重磅研究,深入分析了超过2000种临床获批药物对细胞内关键过程——DNA修复和CRISPR基因组编辑结果的影响,揭示了药物相互作用的潜在风险,同时也为治疗DNA修复缺陷型癌症开辟了全新的“合成致死”策略。
这项研究的发现对于正在寻求创新治疗方案的癌症患者及其家属至关重要。它不仅提醒临床医生和研究人员在设计治疗方案时必须考虑药物相互作用,更重要的是,它确定了数种已获批准的药物,可能通过“重定向”(Repurposing)的方式,成为治疗特定类型癌症的有前景的候选药物。

理解精准治疗的基石:CRISPR与DNA修复
要理解药物如何影响治疗结果,首先需要了解CRISPR基因组编辑和细胞的DNA修复机制。
什么是CRISPR-Cas9基因编辑技术?
CRISPR-Cas9系统被誉为“基因剪刀”,它允许科学家在基因组的特定位置精确切割DNA。在基因治疗中,研究人员利用CRISPR在致病基因位点制造一个DNA双链断裂(Double-Strand Break, DSB),然后引导细胞利用提供的DNA模板进行修复,从而实现基因的精确修正或敲除。
DNA双链断裂:细胞的生死攸关时刻
DNA双链断裂是基因组中最严重的损伤之一,细胞必须立即启动修复机制才能存活。细胞主要依赖两种关键的修复通路:
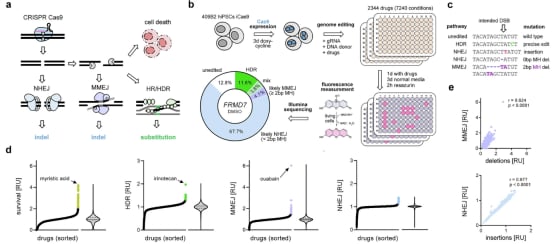
- 非同源末端连接(NHEJ):这是一种快速、但容易出错的修复方式。它直接将断裂的两端连接起来,通常会在断裂位点引入小的插入或缺失(突变)。在CRISPR编辑中,NHEJ常用于基因敲除,因为它能有效破坏基因功能。
- 同源定向修复(HDR):这是一种耗时较长、但高度精确的修复方式。它需要一个同源的DNA模板(通常是姐妹染色单体或研究人员提供的模板)来指导修复,从而实现精确的基因修正。在CRISPR编辑中,HDR是实现精确突变整合的关键。
基因编辑的效率和精确性,在很大程度上取决于细胞倾向于选择哪种修复通路。如果细胞过度活跃地使用NHEJ,那么精确的HDR编辑效率就会大大降低。因此,研究人员一直在寻找能够抑制竞争性修复通路、提高预期编辑结果效率的工具。
药物相互作用图谱:影响CRISPR疗效的潜在因素
随着首个基于CRISPR的基因疗法(如针对镰状细胞病和β地中海贫血的疗法)获批进入临床,了解患者日常服用的药物如何与这些创新疗法相互作用,变得前所未有的重要。
马克斯-普朗克进化人类学研究所的科学家们正是基于这一需求,系统性地研究了FDA批准的药物对DNA修复通路选择的影响。他们测试了超过7000种药物条件,创建了一个全面的图谱,详细展示了每种化合物在CRISPR切割后如何改变人类细胞修复断裂DNA的方式。
这项研究的共同第一作者Dominik Macak指出:“随着这些疗法进入现实世界的临床使用,了解日常药物如何与基于CRISPR的治疗相互作用将变得越来越重要。”
研究结果证实,许多常规药物确实能够影响主要的DNA修复通路。这意味着,如果患者在接受CRISPR基因治疗期间同时服用某些常见药物,可能会:
- 降低疗效:如果药物激活了错误的修复通路(如NHEJ),可能会降低精确基因编辑(HDR)的效率。
- 影响安全性:如果药物干扰了细胞正常的DNA修复能力,可能会增加基因组不稳定性或脱靶效应的风险。
对于正在考虑或已经开始创新治疗的患者,了解药物相互作用的风险至关重要。患者可以通过专业的AI辅助问诊服务,获取关于治疗方案和药物相互作用的初步信息,以便更好地与主治医生沟通。
发现精准治疗新靶点:ESR2与AOX1
利用筛选数据,研究团队进一步探索了对修复结果影响最大、但此前未被充分认识的药物靶点。他们发现了两种此前与基因组编辑和DNA修复没有直接关联的蛋白质,在DNA修复中扮演了新角色:雌激素受体2(ESR2)和醛氧化酶1(AOX1)。
ESR2:提高基因编辑效率的潜力
研究发现,靶向抑制ESR2(Estrogen Receptor 2)可以将精确基因编辑(HDR)的效率提高高达四倍。这意味着,如果能开发出ESR2抑制剂,并将其与CRISPR系统结合使用,将极大地提高基因治疗的成功率和精确度。虽然ESR2主要与激素信号传导相关,但其在DNA修复中的新功能揭示了细胞机制的复杂性。
AOX1:针对DNA修复缺陷型癌症的“合成致死”策略
更令人兴奋的发现是关于醛氧化酶1(AOX1)。研究表明,抑制AOX1的药物可以用于选择性杀死培养的癌细胞,尤其是那些缺乏特定DNA修复通路的癌细胞。这正是癌症精准治疗中一个强大的概念——“合成致死”(Synthetic Lethality)。
合成致死:超越现有疗法的癌症治疗新思路
“合成致死”是指两个非致死性基因突变或抑制剂的组合,当它们同时存在时会导致细胞死亡。在癌症治疗中,这意味着如果癌细胞已经天然地失去了一个关键的修复机制(例如,由于基因突变),我们只需要用药物抑制另一个互补的修复机制,就能选择性地杀死癌细胞,而对正常细胞影响较小。
DNA修复缺陷型癌症的治疗困境与机遇
许多癌症,特别是乳腺癌、卵巢癌和前列腺癌,常常携带BRCA1/2等基因突变,导致它们失去了同源定向修复(HDR)的能力,属于典型的“DNA修复缺陷型”癌症。目前,针对这类癌症的经典精准疗法是PARP抑制剂(如奥拉帕利Olaparib、尼拉帕利Niraparib)。PARP抑制剂通过抑制单链DNA修复,迫使癌细胞依赖其已缺陷的HDR通路进行修复,最终导致细胞死亡。
然而,癌细胞最终会对PARP抑制剂产生耐药性。因此,寻找新的合成致死靶点至关重要。
AOX1抑制剂的潜力
这项新研究表明,抑制AOX1可以作为一种新的合成致死策略,针对那些已经失去某种DNA修复通路的癌细胞。这意味着AOX1抑制剂可能成为治疗PARP抑制剂耐药癌症或作为一线治疗的新选择。
研究高级研究员Stephan Riesenberg表示:“我们的研究确定了几种已获批准的药物,作为治疗DNA修复缺陷癌症的有前景的候选药物,提供了超越当前疗法的潜在选择。”由于这些药物已经获得了临床批准,它们的安全性和药代动力学数据已知,可以大大加速它们的“药物重定向”过程,更快地进入临床试验阶段。
临床转化与患者启示
这项研究的价值在于为癌症精准治疗和基因编辑技术提供了两个关键方向:优化现有技术和开发新的治疗药物。
1. 优化基因治疗的效率
通过识别和抑制如ESR2这样的靶点,未来的CRISPR基因疗法可以实现更高的精确编辑效率,这对于治疗遗传性疾病和某些癌症至关重要。
2. 拓展癌症治疗武器库
通过识别AOX1等新靶点,为DNA修复缺陷型癌症提供了新的合成致死策略。这对于那些对传统靶向药(如PARP抑制剂)产生耐药的患者来说,无疑是巨大的福音。
患者在寻求创新疗法时的注意事项
对于正在与癌症抗争的患者而言,这项研究提供了重要的启示:
- 警惕药物相互作用:在接受任何创新疗法(包括化疗、靶向药或未来的基因疗法)时,务必向医生详细报告所有正在服用的药物,包括非处方药和补充剂,以避免影响治疗效果。
- 关注前沿信息:许多突破性的治疗方法和药物,如针对特定靶点的创新疗法,可能尚未在中国上市。患者可以通过关注药物信息、治疗方案解读等渠道,及时了解国际前沿的临床研究进展。
- 探索海外购药渠道:如果研究成果转化为临床药物,并且在海外率先获批,患者可能需要通过合法的国际直邮或代购服务获取这些创新药物。MedFind提供抗癌药品代购与国际直邮服务,帮助患者获取全球范围内的救命药。
当然,研究人员也强调,目前这些发现主要基于培养细胞实验,需要进一步的临床前和临床研究来验证其在真实世界医疗应用中的有效性和安全性。但无疑,这项工作为癌症精准治疗的未来奠定了坚实的基础,预示着通过药物重定向和对DNA修复机制的深入理解,我们将能更有效地对抗癌症。