引言:为非小细胞肺癌治疗导航,精准基因检测是关键
在非小细胞肺癌(NSCLC)的精准治疗时代,准确识别驱动肿瘤生长和进展的基因变异,是为患者制定个性化、高效治疗方案的基石。在众多基因变异类型中,“基因扩增”是一种重要的形式,它意味着特定致癌基因的拷贝数异常增加,如同给癌细胞的“引擎”加了多倍的燃料,从而驱动其恶性增殖。针对这些扩增的基因,靶向药物能够精准打击,为患者带来显著的生存获益。
长期以来,荧光原位杂交(FISH)技术被公认为检测基因扩增的“金标准”。然而,随着我们对肿瘤基因组学认识的加深,FISH技术的局限性也日益凸显。与此同时,新一代测序技术(Next-Generation Sequencing, NGS)作为一种强大的基因组分析工具,正越来越多地应用于临床。那么,NGS能否替代FISH,成为评估非小细胞肺癌基因扩增的可靠新标准?一项真实世界研究为我们提供了有力的证据。
传统“金标准”FISH检测面临的挑战
FISH技术通过使用荧光标记的探针与细胞内的特定DNA序列结合,能够在显微镜下直观地“看到”基因拷贝数的多少,从而判断是否存在扩增。它在高分辨率和特异性方面具有不可替代的优势,尤其是在肿瘤细胞含量低或存在局灶性扩增的情况下。
然而,FISH的临床应用也面临着诸多现实挑战:
- 通量低:每一次FISH检测通常只能针对一个基因进行,如果需要评估多个潜在的靶点,就需要进行多次检测,耗时耗力。
- 样本需求量大:每增加一个检测指标,就需要一张新的肿瘤组织切片。对于许多通过穿刺活检获取小样本的肺癌患者而言,宝贵的组织样本往往难以满足多基因检测的需求。
- 依赖主观判断:检测结果的判读依赖于病理医生的经验,不同观察者之间可能存在差异,从而引入结果的变异性。
- 成本与时间:进行多基因的FISH检测不仅成本高昂,而且周转时间较长,可能延误最佳治疗时机。
这些局限性凸显了开发一种更全面、高效、客观的基因扩增检测方法的迫切性,而NGS技术正是在这一背景下应运而生。
NGS技术能否担起重任?真实世界研究揭示真相
为了评估NGS作为预测基因扩增工具的准确性,研究人员进行了一项真实世界研究,直接对比了NGS和FISH在非小细胞肺癌样本中的检测结果。该研究共纳入了66例同时接受两种检测的原发性NSCLC样本,重点分析了几个在NSCLC中具有重要临床意义的基因:MET、ERBB2(即HER2)、PIK3CA和KRAS。
研究的核心在于比较NGS检测得出的“倍数变化(fold change)”与FISH检测的两个金标准指标——“基因/着丝粒(CEN)比值”和“细胞平均基因拷贝数(GCN)”之间的相关性。NGS的“倍数变化”可以通俗地理解为目标基因的测序深度相对于整个基因组背景的增高倍数。
核心发现:NGS与FISH检测结果高度一致
研究结果令人振奋。数据显示,NGS的倍数变化与FISH的基因/CEN比值(Spearman’s ρ=0.720, p<0.001)以及细胞平均GCN(Spearman’s ρ=0.847, p<0.001)均呈现出极强的正相关性。这意味着,NGS检测到的基因覆盖度越高,FISH检测出的基因扩增程度也越显著。
更具临床指导意义的是,研究人员找到了一个清晰的界值:
当NGS倍数变化以2.0为临界值时,可以非常有效地将基因扩增阳性与阴性样本区分开来。
- FISH检测为阴性的样本,其NGS倍数变化范围在0.57至1.95之间。
- FISH检测为阳性的样本,其NGS倍数变化范围则在2.11至25.08之间。
这一发现表明,NGS不仅能够定性地判断是否存在扩增,其定量的“倍数变化”值还能很好地反映扩增的程度,为临床决策提供了可靠的量化依据。
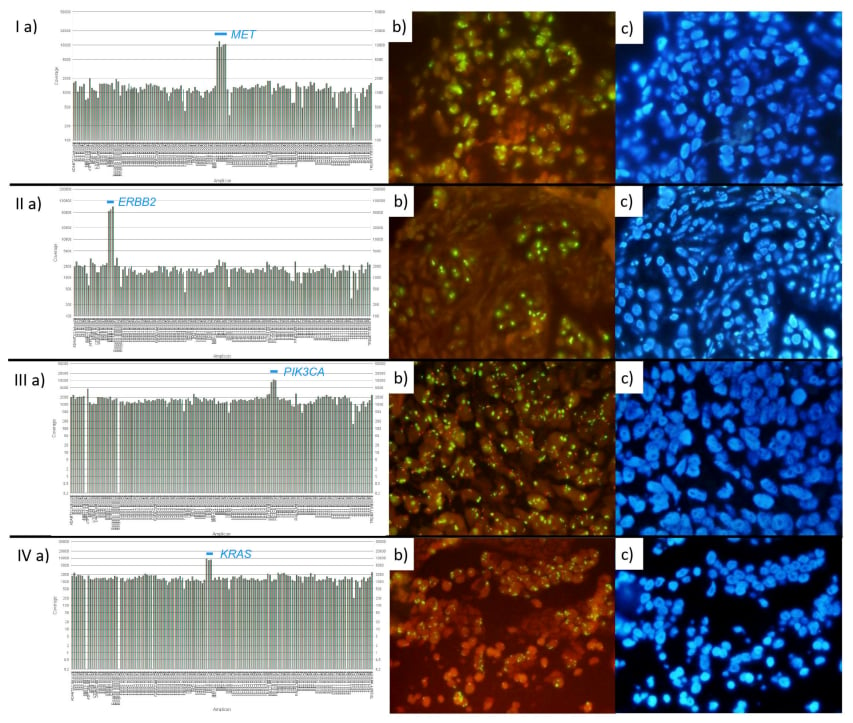

图1:不同基因扩增的NGS覆盖度与对应的FISH图像

图2:NGS倍数变化与FISH指标的强相关性
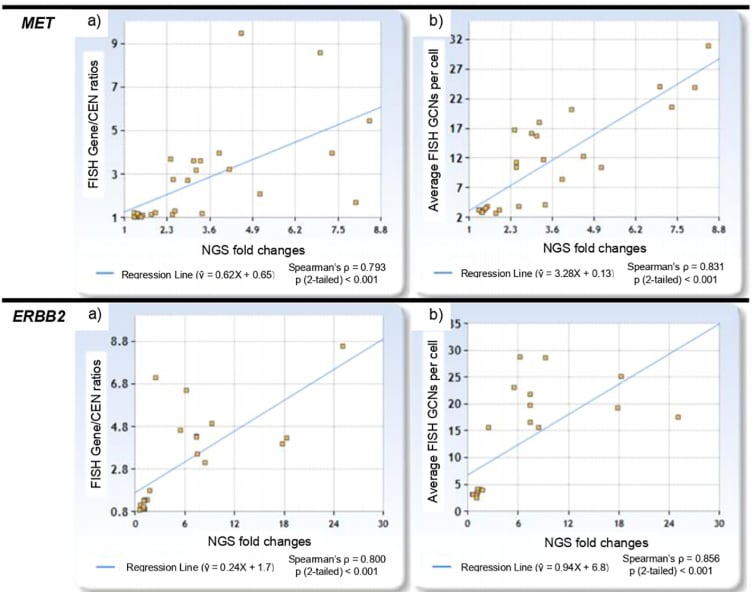
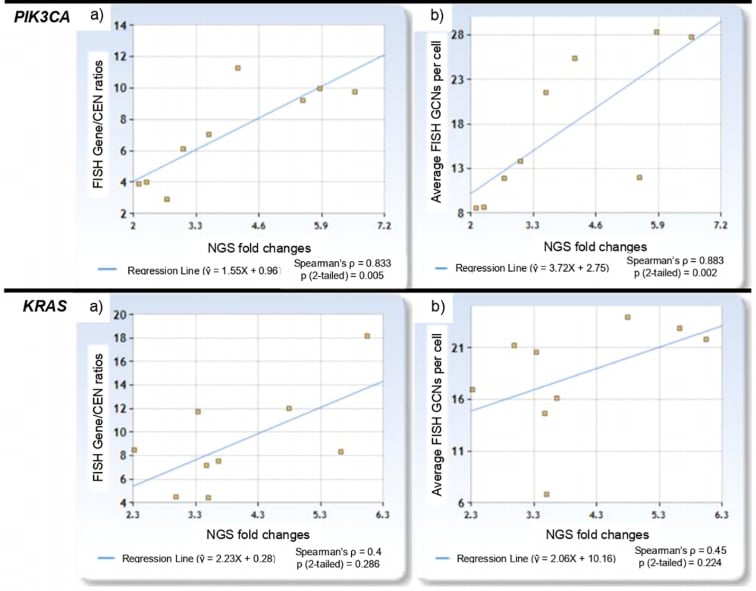

图3:各基因的线性回归分析
NGS检测在临床应用中的独特优势
这项研究证实了NGS在检测基因扩增方面的可靠性,更凸显了其作为一种全面性检测平台的巨大优势。与一次只能检测一个靶点的FISH不同,NGS具有“一箭多雕”的能力:
- 全面的基因组信息:单次NGS检测可以同时分析数百个与癌症相关的基因,不仅能发现基因扩增(拷贝数变异,CNV),还能检测点突变、插入/缺失、基因融合等多种变异形式。
- 评估新兴生物标志物:除了传统的驱动基因,NGS还能评估肿瘤突变负荷(TMB)、微卫星不稳定性(MSI)、同源重组缺陷(HRD)等新兴的免疫治疗和PARP抑制剂相关的生物标志物。
- 节约宝贵样本和时间:对于活检样本有限的患者,NGS能够用最少的组织获取最全面的信息,避免了因样本不足而错失检测机会。同时,其总周转时间通常比进行多项单基因检测更短。
当检测到MET或ERBB2等特定基因扩增时,意味着患者可能从特定的靶向药物中获益。了解这些前沿靶向药物的获取渠道、价格及直邮服务,对于后续治疗至关重要。同时,面对复杂的NGS报告,如何准确解读并匹配最佳治疗方案是患者和家属面临的难题。为了帮助患者一站式获取全面的基因组信息,MedFind AI问诊服务可以为您免费解读基因检测报告,匹配最前沿的治疗方案。
挑战与展望:如何最大化NGS的检测效能?
尽管NGS展现出巨大潜力,但要完全替代FISH,仍需正视其在应用中存在的一些挑战和需要进一步优化的地方。该研究也坦诚地指出了几个关键点:
- 肿瘤细胞含量(TCC)的影响:NGS检测的是肿瘤组织和正常组织细胞的混合体。如果样本中肿瘤细胞的比例过低(例如≤20%),来自正常细胞的DNA会“稀释”肿瘤细胞的基因扩增信号,可能导致NGS低估扩增水平,甚至造成假阴性结果。因此,在解读NGS报告时,必须结合病理评估的肿瘤细胞含量。
- NGS Panel设计的局限性:目前临床使用的NGS Panel通常只覆盖特定基因的关键外显子区域,而非整个基因。如果基因扩增的区域恰好位于Panel未覆盖的内含子或其他区域,就可能被漏检。
- 复杂的基因组现象:在某些情况下,肿瘤细胞可能表现为“高多体性”,即整个染色体都发生了倍增,这会导致平均基因拷贝数(GCN)升高,但基因/CEN比值正常。如何利用NGS算法精准区分真正的基因扩增和高多体性,是未来需要优化的方向。
未来的研究方向应包括在更大规模的患者队列中验证2.0这一临界值,并纳入更多类型的基因扩增(如NSCLC中常见的EGFR扩增),以评估其普适性。此外,通过优化算法、扩大基因覆盖范围,有望进一步提升NGS检测的灵敏度和特异性。
结论:NGS为非小细胞肺癌患者开启全面基因检测新时代
总而言之,这项真实世界研究有力地证明,NGS在评估非小细胞肺癌的基因扩增方面是一种高度可靠、高效且全面的工具。其检测结果与金标准FISH高度相关,特别是当倍数变化超过2.0时,可以作为基因扩增的有力证据。
对于非小细胞肺癌患者而言,选择NGS检测意味着可以用一份宝贵的组织样本,获得一张详尽的“基因图谱”,全面了解包括基因扩增在内的多种潜在治疗靶点,为后续的靶向治疗、免疫治疗乃至临床试验的选择提供最全面的信息支持。随着技术的不断成熟和标准化,NGS有望成为常规诊断流程中的核心工具,引领非小细胞肺癌进入一个更加精准、高效的个体化治疗新时代。获取更多关于非小细胞肺癌的最新诊疗资讯和药物信息,将帮助您在抗癌路上做出更明智的决策。





