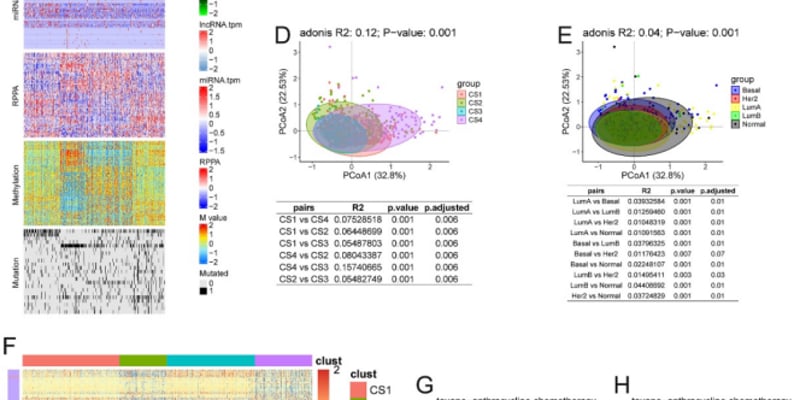
对于乳腺癌等深层实体瘤,如何实现精准、高效的治疗一直是医学界面临的重大挑战。传统的光热治疗(PTT)在应用于深层组织时,常因光的穿透深度有限而效果打折扣。近日,一项由香港科技大学、华东师范大学及广州医科大学的科学家们联合发表在Cell Biomaterials上的研究,为这一难题带来了创新的解决方案。

创新的光热/NO协同治疗策略
研究团队提出了一种全新的策略,巧妙地将可见光响应的光热剂与上转换纳米粒子(UCNPs)结合。简单来说,上转换纳米粒子就像一个“能量转换器”,它能吸收穿透力更强的1064纳米近红外II区(NIR-II)光,并将其转换为可见光,从而激活位于深层肿瘤组织中的光热剂,产生热量杀死癌细胞。
更进一步,研究人员还将这一复合光热剂与一种热敏感的一氧化氮(NO)前药结合,构建了一个协同治疗平台。当肿瘤组织在激光照射下升温时,该平台不仅能发挥光热效应,还能同步释放一氧化氮气体。一氧化氮本身就具有抗肿瘤作用,并能与光热治疗产生“1+1>2”的协同效应,从而更有效地摧毁癌细胞。虽然这项技术仍处于研究阶段,但它代表了未来癌症治疗的方向。如果您想了解当前已获批的乳腺癌靶向药或创新疗法,可以访问MedFind抗癌资讯获取更多信息。

图1. 材料制备和肿瘤治疗示意图
关键研究成果:高效抑制肿瘤与转移
为了验证这一新型疗法的效果,研究团队在植有4T1乳腺癌细胞的模型上进行了体内外实验。结果显示,在1064纳米激光的照射下,该治疗体系表现出以下显著优势:
- 强大的肿瘤杀伤力:通过光热与一氧化氮的协同作用,该疗法能够有效诱导癌细胞凋亡,显著抑制乳腺癌肿瘤的生长。
- 抑制癌症肺转移:实验结果证实,该协同治疗不仅对原位肿瘤有效,还能有效抑制乳腺癌向肺部的转移,这对于改善患者的远期预后至关重要。
这些鼓舞人心的数据为乳腺癌患者带来了新的希望。在寻求最佳治疗方案的过程中,充分了解各种药物和疗法至关重要。MedFind的AI问诊服务可以帮助您梳理复杂的医疗信息,为您提供个性化的治疗建议参考。

图2. 可见光PTAs的合成及520 nm激发的光热性能

图3. UPTA的构建及1064 nm激发的光热效应

图4. UPTA/SNP@H的制备及1064 nm激发的光热效应

图5. UPTA/SNP@H介导的光热治疗体外细胞毒性

图6. UPTA/SNP@H的体内抗肿瘤疗效

图7. 抑制癌症肺转移
研究意义与展望
这项研究的成功不仅为光热剂的设计与合成提供了简便高效的新思路,更重要的是,它通过上转换机制,成功将应用受限的可见光光热剂拓展到了能够治疗深层组织的NIR-II治疗领域。这一突破丰富了光热治疗的材料体系,为未来开发更多样化、更高效的深层组织肿瘤治疗方案开辟了新的道路。对于需要海外靶向药的患者,MedFind提供专业、可靠的代购服务,助您轻松获取前沿治疗药物。