Zongertinib一线治疗HER2突变非小细胞肺癌:客观缓解率高达77%
在2025年欧洲肿瘤内科学会(ESMO)年会上,一项针对HER2突变非小细胞肺癌(NSCLC)的重磅研究数据公布,为初治患者带来新希望。根据1期临床试验Beamion LUNG-1(NCT04886804)的结果,靶向药Zongertinib(Hernexeos)在一线治疗中显示出显著且具有临床意义的疗效。
Beamion LUNG-1试验:Zongertinib疗效数据惊艳
该研究结果显示,Zongertinib在治疗HER2突变的晚期非小细胞肺癌患者方面取得了令人鼓舞的成果。主要疗效数据如下:
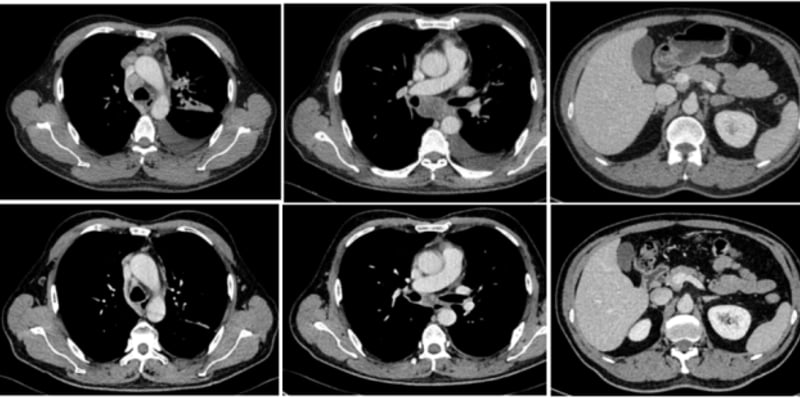
客观缓解率(ORR):高达 77%(95% CI, 66%-85%),其中完全缓解率为8%,部分缓解率为69%。这意味着超过四分之三的患者肿瘤显著缩小。
疾病控制率(DCR):达到了 96%(95% CI, 89%-99%),仅有1%的患者出现疾病进展。
起效与持续时间:中位起效时间仅为1.4个月,显示药物能快速产生效果。6个月的持续缓解率(DOR)为80%,6个月的无进展生存率(PFS)为79%,表明其疗效持久稳定。截至数据分析时,仍有47%的患者在继续接受治疗。
如果您对Zongertinib或其他肺癌靶向药的最新信息感兴趣,可以访问MedFind抗癌资讯获取更多详情。
哪些患者从Zongertinib治疗中获益?
此次公布的数据主要集中在Beamion LUNG-1试验的队列2,该队列纳入了74名未经治疗(即一线治疗)且携带HER2酪氨酸激酶结构域(TKD)突变的晚期非小细胞肺癌患者。入组患者需年满18岁,ECOG评分为0或1,并且允许稳定的、无症状的脑转移患者参加。
研究负责人Sanjay Popat博士强调:“无论患者携带哪种具体的HER2突变类型,Zongertinib都展现出了临床获益。” 这表明Zongertinib具有广泛的治疗潜力。对于复杂的病情或治疗选择,您也可以考虑使用MedFind的AI问诊服务,获取个性化的分析和建议。
Zongertinib的安全性与副作用分析
在评估任何新药时,安全性都是患者和医生最关心的问题之一。Zongertinib的整体安全性与既往报道的数据一致,表现出良好的耐受性。
主要不良反应: 91%的患者报告了治疗相关不良事件(TRAEs),但大多数为轻中度。最常见的不良反应包括腹泻(54%)、皮疹(23%)、丙氨酸转氨酶升高(18%)、天冬氨酸转氨酶升高(16%)、味觉障碍(16%)和恶心(16%)。
严重不良反应: 3级TRAE的发生率为18%,未报告4级或5级(致命性)TRAE。因不良事件导致剂量减少或停药的比例较低,分别为15%和9%。值得注意的是,间质性肺病/肺炎的发生率很低,仅有2例2级事件报告。
总体而言,Zongertinib的副作用可控,严重不良事件发生率低,这对于需要长期用药的患者至关重要。
Zongertinib的研发与审批前景
值得一提的是,早在2025年8月,美国食品药品监督管理局(FDA)已加速批准Zongertinib用于治疗既往接受过治疗的、携带HER2 TKD激活突变的转移性或不可切除非鳞状NSCLC患者。此次一线治疗数据的优异表现,无疑将进一步巩固其在HER2突变肺癌治疗领域的地位,并有望推动其适应症的扩展。
对于需要海外靶向药的患者,MedFind提供专业的代购服务,确保药物的安全可靠获取,帮助您第一时间用上最新的治疗方案。