GIST诊断的“金标准”与伊马替尼的挑战
胃肠道间质瘤(GISTs)是胃肠道最常见的间叶源性肿瘤,其诊断的“金标准”依赖于组织形态学结合免疫组织化学(IHC)检测。其中,KIT/CD117和DOG1这两个蛋白标志物至关重要,联合检测可在超过98%的病例中实现精准诊断。
靶向药物,特别是酪氨酸激酶抑制剂(TKI)如伊马替尼,彻底改变了GIST的治疗格局,为众多晚期或转移性患者带来了希望。如果您想了解更多前沿靶向药的代购信息和价格,可以访问MedFind。然而,长期治疗后,部分患者会出现耐药和疾病进展。一个棘手的临床问题随之而来:肿瘤的组织学形态可能发生改变,甚至出现关键诊断标志物KIT/CD117和DOG1表达缺失的现象,这为确认疾病复发或转移设置了巨大的障碍。
病例分享:伊马替尼治疗后免疫标志物“隐身”
本文报告了一例典型的疑难病例。患者为一名55岁女性,6年前因胃GIST接受了胃部分切除术。近期检查发现其肝脏出现一个4.0厘米的新发肿块。最初的肝活检显示为CD117阳性的转移性GIST,因此患者开始接受伊马替尼治疗。
尽管初期治疗有效,但两年后,患者病情进展,肝脏出现多发病灶。在接受右肝切除术后,病理检查发现了一个令人困惑的结果:无论是肿瘤中分化较好的梭形细胞区域,还是形态更差的间变(未分化)细胞区域,其CD117和DOG1的免疫组化检测结果均持续为阴性。这与治疗前的诊断结果完全相反。
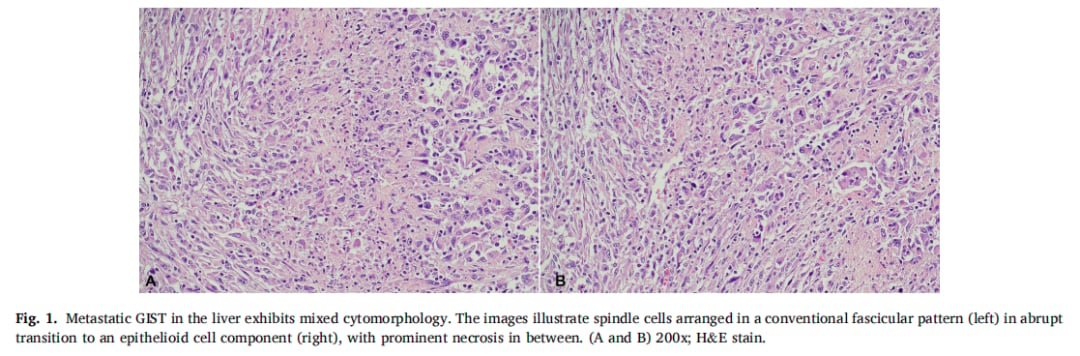
▲图1 胃肠道间质瘤 (GIST) 肝转移灶呈现混合细胞形态
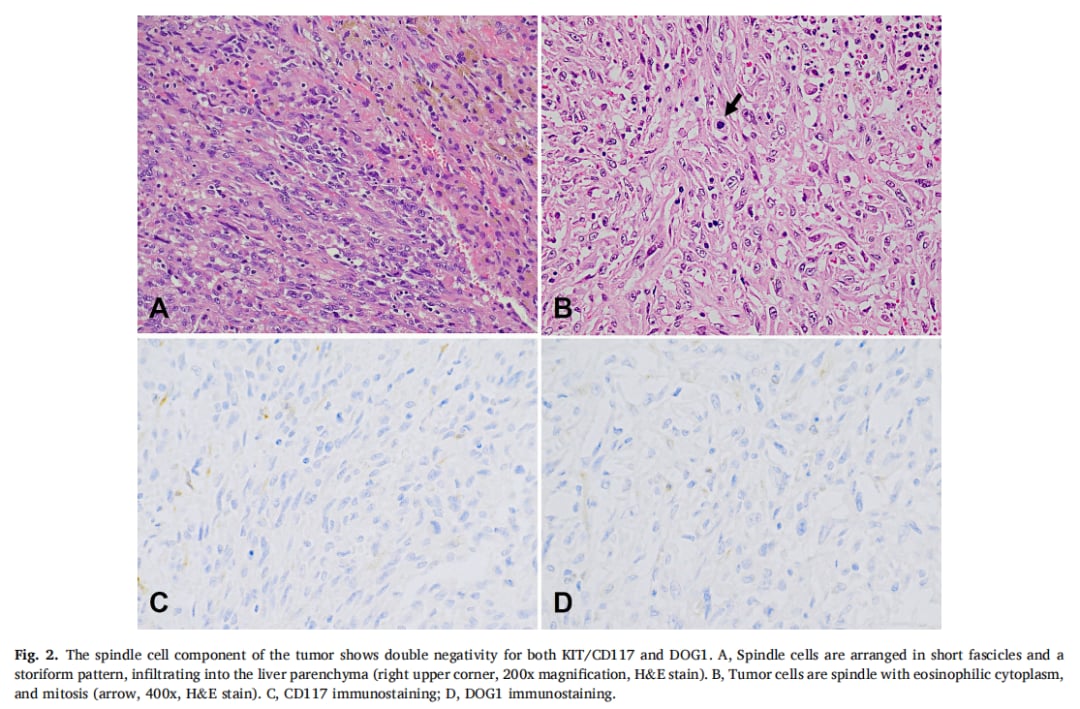
▲图2 肿瘤梭形细胞成分KIT/CD117和DOG1双阴性
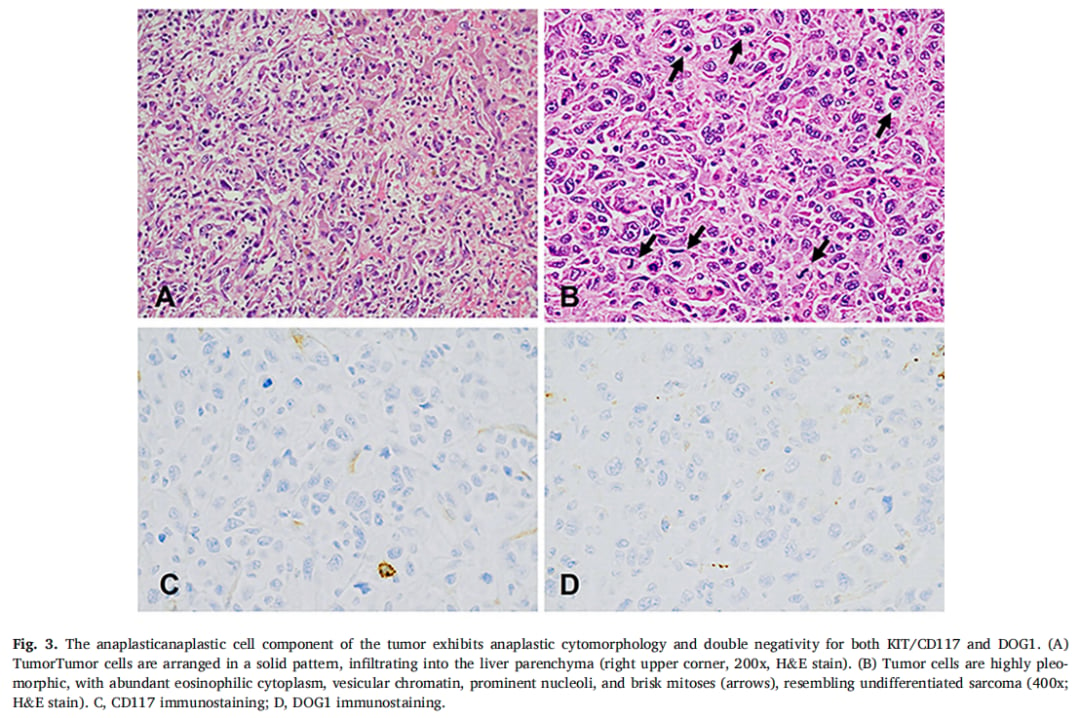
▲图3 肿瘤的间变性细胞成分表现出间变性细胞形态,且KIT/CD117和DOG1双阴性
分子检测:揭开“伪装”的关键
面对免疫组化标志物双阴性的困境,医生们转向了分子检测。结果发现,肿瘤组织中存在c-Kit基因11号外显子的缺失突变。这一发现为诊断提供了决定性证据,最终确认这些肝脏病灶确实是GIST的转移灶。这个案例凸显了在常规诊断方法失效时,分子检测不可替代的关键作用。
这一现象不仅增加了诊断的复杂性,也给后续治疗方案的选择带来了困扰。如果您在治疗过程中遇到类似难题,可以尝试使用MedFind的AI问诊服务,获取专业的第二诊疗意见。
为何免疫标志物会“消失”?
伊马替尼治疗后GIST免疫表型的改变并非个例。一篇文献回顾分析了包括本案例在内的15例类似病例,发现肝脏和腹膜是最常见的转移部位,伊马替尼耐药的平均发生时间约为23.8个月。这些耐药肿瘤均表现出形态学上的“去分化”,并伴随CD117表达的缺失。
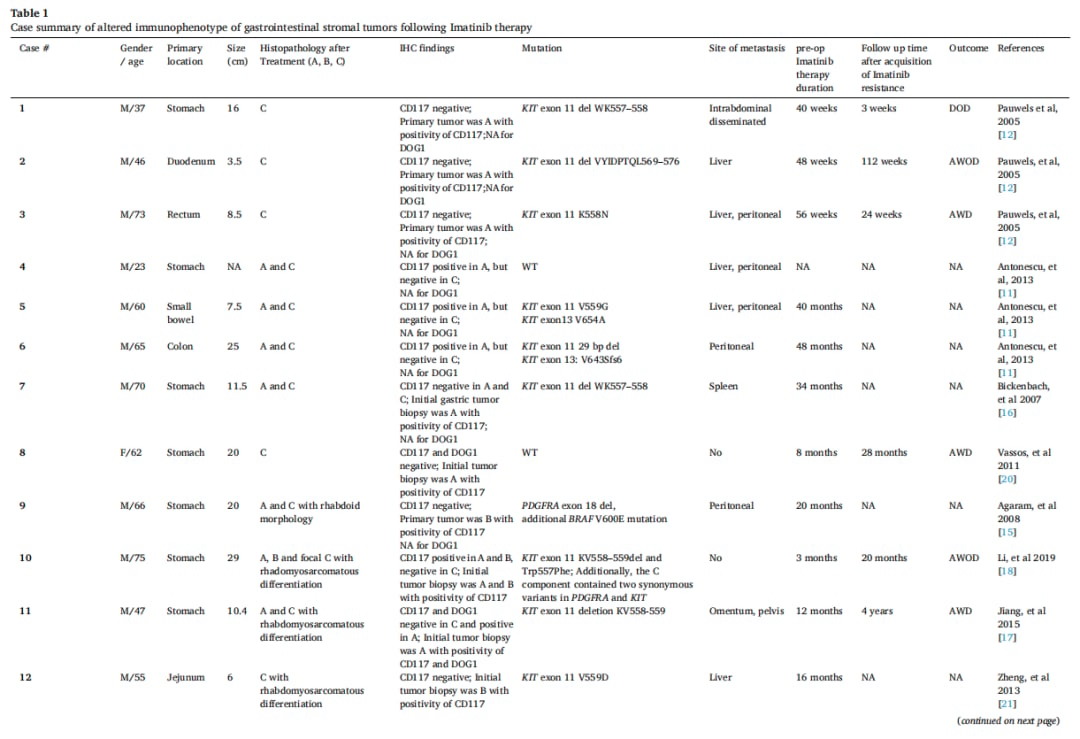
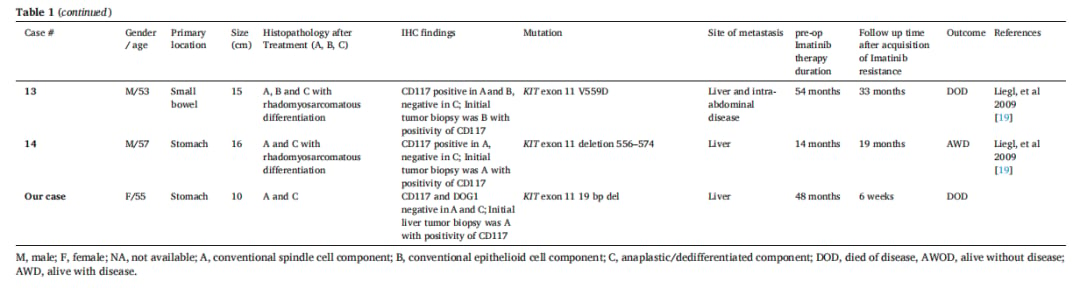
▲表1 伊马替尼治疗后胃肠道间质瘤免疫表型改变的病例汇总
其背后的机制尚不完全清楚,可能的原因包括:
- KIT信号通路下调:长期的伊马替尼抑制可能导致肿瘤细胞下调KIT蛋白的表达。
- 遗传不稳定性:肿瘤在治疗压力下可能发生新的基因突变或杂合性缺失,导致表型改变。
- 肿瘤微环境调节:治疗可能改变肿瘤微环境,间接影响诊断标志物的表达。
- 肿瘤去分化:类似于其他肉瘤,GIST也可能发生去分化,转化为更高级别的肿瘤,并在这个过程中丢失原有的标志物。
结论与启示
本案例警示我们,对于接受伊马替尼治疗的GIST患者,当出现疑似复发或转移的病灶时,即使常规的免疫组化检测(CD117和DOG1)结果为阴性,也不能轻易排除GIST的可能性。在这种情况下,进行分子基因检测(如KIT或PDGFRA基因突变分析)是确诊的关键一步。临床医生和病理学家需要认识到这一潜在的诊断陷阱,以确保患者能够得到及时、准确的诊断和后续治疗。了解这些复杂的生物学现象,有助于患者和医生做出更明智的决策。更多关于癌症治疗的最新资讯,欢迎访问MedFind抗癌资讯版块。





