导言
对于分化型甲状腺癌患者而言,放射性碘(RAI)治疗是一种常规且有效的手段。然而,部分患者在治疗后会出现放射性碘难治(RAIR)的情况,尤其是在存在特定基因突变(如RET融合)时,治疗会变得更加棘手。近年来,靶向治疗结合再分化治疗(RDT)策略为这类患者带来了新的希望。本文将分享一例携带NCOA4::RET融合的转移性甲状腺乳头状癌(PTC)患者,如何通过靶向药塞普替尼(Selpercatinib)的再分化治疗,成功逆转耐药,并实现了长达24个月的持续完全缓解。

▲碘难治性分化型甲状腺癌的治疗进展及展望
再分化治疗:唤醒肿瘤细胞对碘的“记忆”
甲状腺癌的发生与MAPK信号通路的异常激活密切相关,这条通路的激活会抑制癌细胞摄取碘的能力,从而导致放射性碘治疗失效。再分化治疗的核心思想就是,通过短期使用靶向药物抑制这条通路,重新“唤醒”癌细胞摄取碘的功能,然后再进行放射性碘治疗,以达到杀灭肿瘤的目的。
研究表明,再分化治疗的效果与肿瘤的驱动基因密切相关。例如,在BRAF V600E突变的患者中,使用BRAF抑制剂可使60%-95%的患者恢复RAI摄取;而在RAS突变的患者中,这一比例也达到了66%-100%。然而,对于占比较小但同样重要的融合驱动型甲状腺癌,相关数据一直较为有限。如果您对自己的病情或治疗方案有疑问,可以尝试MedFind的AI问诊服务,获取专业的第二诊疗意见。
病例回顾:从快速进展到完全缓解的逆转
本案例的主角是一位年仅22岁的女性患者,她被诊断为NCOA4::RET融合驱动的甲状腺乳头状癌,并已出现肺部转移。尽管在19岁时接受了手术和首次RAI治疗,但病情很快复发并快速进展,对常规RAI治疗不再敏感,被确认为放射性碘难治性(RAIR)。
面对困境,医生团队决定采用一种创新的治疗策略:使用选择性RET抑制剂塞普替尼进行为期3个月的再分化治疗,然后再进行第二次大剂量的RAI治疗。
治疗过程与结果:
- 塞普替尼预治疗:患者每日两次口服160mg的塞普替尼,耐受性良好。在此期间,她的肿瘤标志物甲状腺球蛋白(Tg)水平从357 ng/mL显著下降至约80 ng/mL。
- RAI摄取恢复:3个月后,影像学检查显示,原本对碘摄取能力很弱的肺部转移灶,在治疗前扫描中表现出弥漫性的中至重度摄取,表明癌细胞已成功“再分化”。
- 联合治疗显神威:随后,患者接受了146 mCi的碘-131治疗。治疗后,患者的甲状腺球蛋白水平持续下降,并在24个月的随访期内维持在极低水平。
- 影像学完全缓解:更令人振奋的是,胸部CT扫描显示,在治疗后18个月,患者的肺部结节已完全消失,并在24个月时得以维持。患者实现了影像学上的完全缓解。
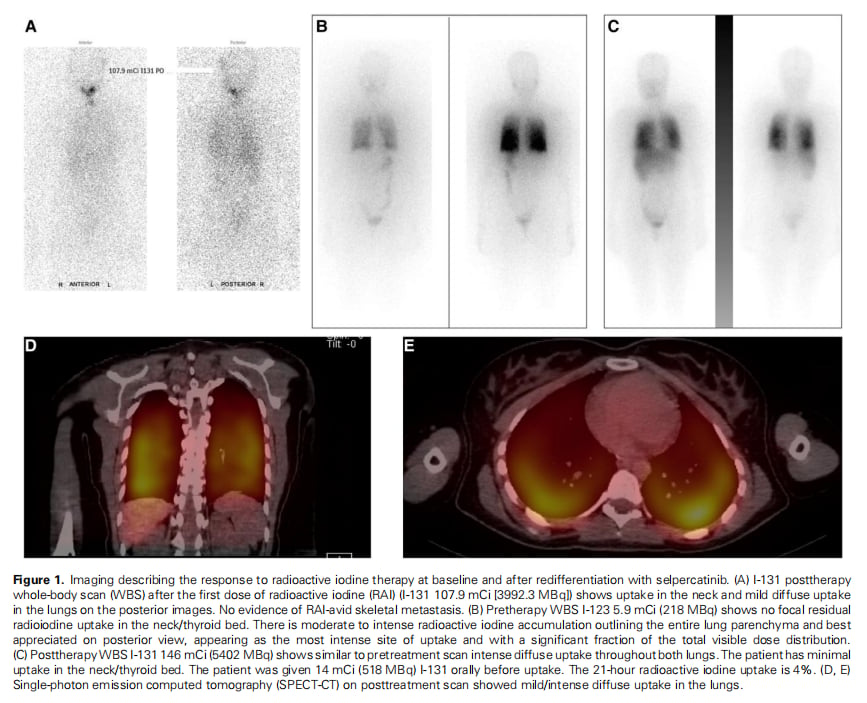
▲图1 基线和使用塞普替尼再分化治疗后对放射性碘治疗的反应
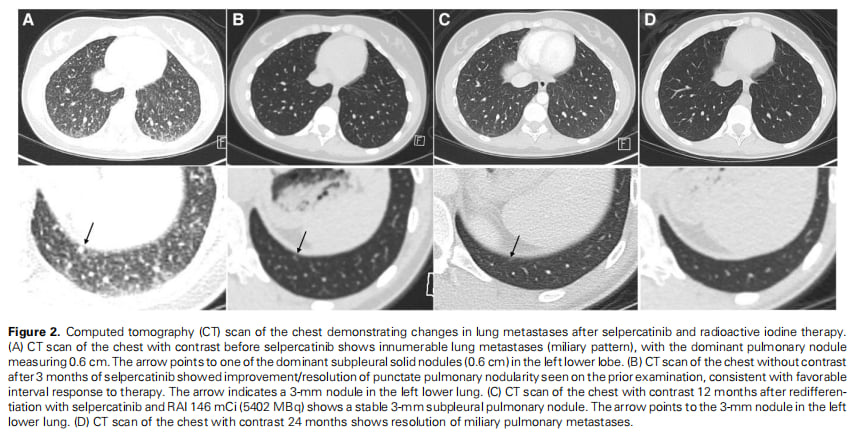
▲图2 胸部CT扫描显示塞普替尼联合放射性碘治疗后肺转移灶的变化
案例启示:靶向联合放疗为RET融合患者带来新希望
这是首例报道的NCOA4::RET融合驱动的RAIR甲状腺癌患者,在接受塞普替尼再分化治疗并停药后,获得长达24个月持续缓解的成功案例。这一结果充分证明了塞普替尼的抗肿瘤效果与碘-131的细胞毒性作用相结合,能够产生1+1>2的协同效应。
对于需要海外靶向药(如塞普替尼)的患者,了解其价格和购买渠道至关重要。MedFind致力于为患者提供专业的药品代购服务,确保药物的正品与可及性,帮助患者及时获得前沿治疗。
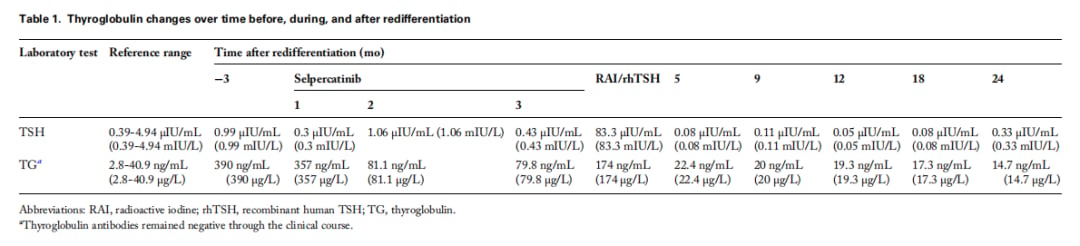
▲表1 甲状腺球蛋白在再分化之前、期间和之后随时间的变化
尽管该案例取得了巨大成功,但仍有许多问题值得进一步探索,例如:
- 最佳治疗时长:再分化治疗需要持续多久才能最大化疗效?
- 疗效预测标志物:如何筛选出最有可能从该疗法中获益的患者?
- 应用时机:是否应在更早的阶段(如辅助治疗)就考虑使用再分化治疗?
这些问题的答案,需要未来更多前瞻性的临床试验来揭晓。
总结
随着对甲状腺癌分子生物学理解的深入,个体化治疗已成为大势所趋。本案例的成功,为RET融合驱动的放射性碘难治性甲状腺癌患者提供了一种极具前景的治疗新策略。通过精准的靶向药物塞普替尼恢复肿瘤细胞对放射性碘的敏感性,有望让更多患者实现长期、深度的缓解,走向更好的未来。想了解更多关于甲状腺癌的前沿治疗资讯,欢迎访问MedFind的抗癌资讯版块。





