在癌症治疗领域,T细胞接合器(TCE)作为一种极具前景的免疫疗法,正不断革新我们对抗肿瘤的方式。它通过重新引导患者自身的T细胞,使其精准识别并清除癌细胞。然而,传统的TCE疗法面临着细胞因子释放综合征(CRS)、脱靶毒性以及肿瘤微环境(TME)免疫抑制等挑战。幸运的是,随着科学技术的进步,TCE的设计正迎来一系列创新,旨在显著提高其安全性和治疗效果。
TCE设计优化:提升精准度与安全性
为了克服现有TCE的局限性,研究人员在多个维度上进行了精巧的设计优化:
1. 优化TCE几何结构与药代动力学
TCE的大小和结构对其疗效和药代动力学(PK)特性至关重要。理想的TCE通常设计得小巧灵活,以促进T细胞与肿瘤细胞之间的紧密接触,形成高效的免疫突触。例如,BiTE(双特异性T细胞接合器)由串联的单链抗体片段(scFv)组成,结构紧凑。然而,由于其较小的尺寸和缺乏Fc段,BiTE在体内清除速度快,需要频繁给药。为解决这一问题,科学家们通过聚乙二醇化、引入白蛋白结合域或与抗体Fc段融合等方式,成功延长了TCE的半衰期,同时不影响其结合特性和药效。
此外,TCE的结构还决定了T细胞与肿瘤细胞之间的突触距离,这对于T细胞的激活和肿瘤细胞的杀伤至关重要。靶向肿瘤相关抗原(TAA)结合臂的定位、靶向表位以及连接子的长度等因素,都影响着免疫突触的有效形成。研究表明,最佳的突触距离约为15纳米,这与天然TCR肽-MHC复合物的大小相符。
TCE的亲和力和价态也是优化的关键。增加对肿瘤靶点的价态(通过结合多个TAA结合结构域)可以增强TCE的亲和力,从而在低TAA表达或异质性TAA表达的肿瘤环境中实现更有效的肿瘤杀伤。例如,具有靶向TAA的双Fab结构域和CD3(2+1形式)的Crossmab型TCE,已在临床前研究和癌症患者中展现出抗肿瘤功效。然而,增加价态可能导致分子更大、更复杂,影响其生物分布。因此,需要在最佳结合强度与有效肿瘤穿透和保留效力之间取得平衡。
2. 精准调控CD3结合亲和力,降低副作用
TCE与T细胞表面CD3/TCR复合物的结合方式和亲和力,显著影响T细胞的激活强度、信号传导以及整体治疗效果,尤其是在改善细胞因子释放综合征(CRS)方面。CRS是TCE疗法常见的副作用,其严重程度受多种因素影响,包括靶抗原表达、肿瘤负荷、TCE剂量和给药方案等。
早期TCE倾向于高亲和力CD3结合,以期在临床前模型中实现强效的肿瘤细胞杀伤。然而,高亲和力结合也常伴随高水平的细胞因子释放,导致严重的CRS和狭窄的治疗窗口。因此,研究人员开始开发具有减弱亲和力的CD3结合臂的TCE。这些新型TCE在体外和体内均能诱导强大的肿瘤抗原特异性细胞毒性,同时显著减少细胞因子释放,从而在有效杀伤肿瘤与降低CRS之间取得了更好的平衡。此外,降低抗CD3结构域的亲和力还有助于改善TCE的生物分布和药代动力学特性,避免其在淋巴组织等富含T细胞的区域过度积聚。
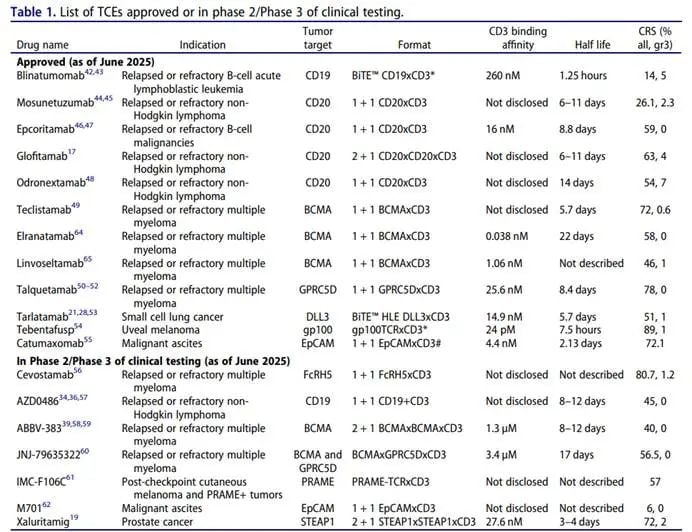
以下表格总结了已批准和处于临床开发后期的TCE的关键特征:
癌症治疗TCE开发的新策略
除了优化TCE的结构和亲和力,科学家们还在探索更多创新策略,以进一步提高TCE的肿瘤特异性和治疗效果:
1. 靶向特定T细胞亚群
选择性激活特定的T细胞亚群,可以减少被激活的T细胞总数,从而降低CRS相关的毒性。研究表明,CD8+T细胞主要负责对癌细胞的直接杀伤,而CD4+T辅助细胞虽然能支持CD8+T细胞功能,但其激活也可能导致细胞因子分泌和CRS。因此,开发能够选择性靶向CD8+T细胞或γδT细胞的TCE,成为降低副作用的有效途径。
例如,AstraZeneca的TITAN平台通过“CD8引导”策略,最大限度地减少了CD4+T细胞的活化,在保持细胞毒性的同时减少了细胞因子释放。Marengo Therapeutics的tri-STAR平台则通过对特定TCR可变β链(Vβ)特异性选择性激活实体瘤中富集的T细胞亚群,实现肿瘤导向的细胞毒性,同时降低CRS风险。此外,针对γδT淋巴细胞的靶EGFR-Vδ2双特异性T细胞接合器(LAVA-1223)也正在临床试验中,有望提供一个减少CRS的机会。
2. 肽-MHC复合物:TCE的新靶点
2022年1月,美国FDA批准了ImmTAC双特异性抗体tebentafsp用于葡萄膜黑色素瘤,这标志着TCE治疗实体瘤的一个重要里程碑。Tebentafsp通过亲和性增强的可溶性TCRαβ可变片段结合癌细胞上的gp100肽-MHC(pMHC)复合物,并利用抗-CD3 scFv引导T细胞活性。这种pMHC特异性TCE为靶向多种癌症抗原(包括细胞内蛋白)提供了可能性,极大地拓宽了免疫疗法的应用范围。
类似地,未成熟T细胞接合受体(TCER)和TCR模拟抗体(TCRm)也在靶向HLA背景下的肿瘤抗原方面展现出巨大潜力。例如,靶向MAGEA4/A8的IMA401和靶向PRAME的IMA402在临床前研究和早期临床试验中显示出有希望的安全性和显著的肿瘤抑制作用。
3. 逻辑门控TCE:增强肿瘤特异性
双靶向TCE是一类新兴的多特异性分子,旨在同时结合两种不同的TAA,以提高癌症免疫疗法的疗效和特异性。它们可以分为OR门控和AND门控两种形式:
- OR门控双靶向TCE: 识别肿瘤细胞表面的一种或两种TAA即可激活T细胞。这种策略有助于克服肿瘤抗原异质性,预防肿瘤复发。
- AND门控双靶向TCE: 通过TAA结合域的亲和力调节,优先靶向共表达两种TAA的肿瘤细胞。这种更严格的靶向方法可以显著提高治疗特异性,降低对健康组织的毒性。例如,三特异性TCE tNY-aCD3/aEGFR在临床前研究中显示出显著提高的治疗效果和选择性,并降低了肿瘤外效应的风险。
4. 基于肿瘤微环境(TME)因素的条件性TCE
条件性活性TCE利用TME的独特生理特性实现精确靶向,同时最大限度地减少全身毒性。这些TCE被设计成仅在TME内普遍存在的特定环境条件下激活,例如:
- 蛋白酶介导的激活: 肿瘤相关蛋白酶在TME中浓度更高。蛋白酶条件性激活的TCE核心是用蛋白酶不稳定的模块阻断CD3和/或TAA结合结构域,直到它们遇到富含蛋白酶的肿瘤环境才被激活。例如,JANX008(Janux Therapeutics)是一种双重掩蔽的条件性抗EGFR TCE,其与CD3和EGFR的结合在蛋白酶激活被阻止时显著受损。
- pH依赖性结合模块: TME的pH通常比正常组织更酸性。利用CDR区中的组氨酸,将抗体的结合结构域设计为对pH敏感,可使TCE在TME的酸性条件下优先具有活性。例如,BF-588-DualCAB在酸性条件下对EpCAM和CD3的亲和力显著提高。
- 高ATP依赖性结合模块: TME中细胞外ATP水平显著升高。例如,STA551是一种抗CD137激动性抗体,在高ATP浓度下能提高其与CD137的结合亲和力,确保其激动效应仅限于肿瘤区域。
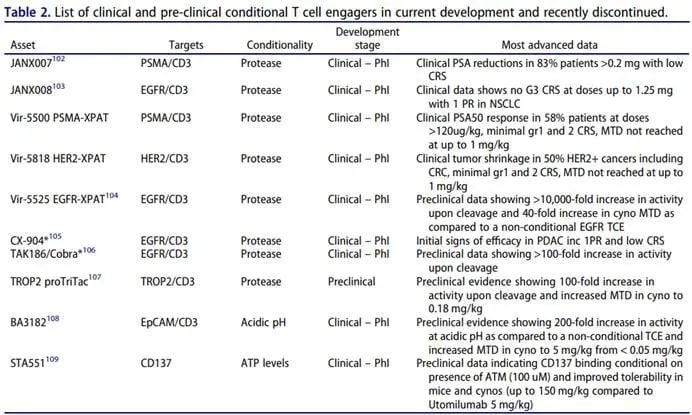
以下表格总结了目前正在开发的临床和临床前条件性TCE:
5. 通过共刺激信号提高TCE疗效
共刺激信号在支持T细胞激活、分化和存活方面发挥着关键作用。通过共刺激信号提高TCE疗效的策略包括靶向共刺激途径的TCE和靶向共刺激的分子与TCE的联合应用。
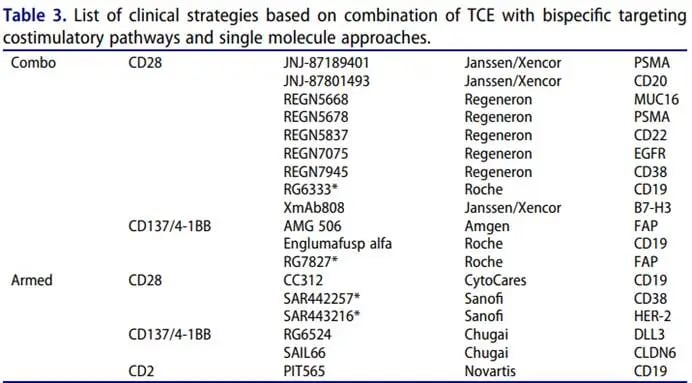
例如,CD20靶向TCE glofitamab与CD19-CD28双特异性抗体联用,可显著增强T细胞在B细胞淋巴瘤中的活性。此外,单分子策略,如靶向DLL3、CD3和CD137的TCE,在小细胞肺癌模型中可同时激活T细胞并提供共刺激信号,增强肿瘤浸润和杀伤。
结语:TCE的未来展望与购药途径
双特异性T细胞接合器(TCE)无疑是当前癌症治疗药物开发的热点方向。下一代TCE的开发将更注重提高肿瘤细胞的杀伤精度和安全性,并有效减轻耐药性的发展。通过微调TCE对CD3/TCR复合物的结合亲和力、实施双靶向策略、设计条件激活机制以及利用共刺激信号,TCE有望在血液学肿瘤和实体瘤环境中取得更优异的治疗结果。
这些创新为TCE这种新型免疫疗法的发展奠定了坚实基础,预示着一个疗效更高、安全性更好的癌症治疗新时代的到来。对于正在寻找先进靶向药的癌症患者及其家属,了解这些前沿进展至关重要。MedFind致力于为全球癌症患者提供海外靶向药代购服务,您可以通过MedFind商城了解更多药物信息并进行购药。同时,我们的AI问诊服务也能帮助您更好地理解复杂的诊疗方案,获取专业的抗癌资讯。





