引言:神经母细胞瘤治疗挑战与焦亡新途径
神经母细胞瘤是儿童期最常见的颅外实体瘤之一,对患儿生命健康构成严重威胁。由于部分肿瘤细胞对传统的凋亡诱导疗法产生抵抗,寻找替代性的细胞死亡途径成为该领域的研究热点。焦亡(Pyroptosis)作为一种程序性细胞死亡形式,近年来在肿瘤治疗中的潜力备受关注。线粒体作为细胞的能量工厂,同时也是活性氧(ROS)的主要来源,在调控细胞死亡(包括焦亡)中扮演着关键角色。了解线粒体功能、ROS信号与细胞焦亡之间的复杂关系,对于开发有效的神经母细胞瘤治疗方案至关重要。
研究核心发现:PINK1抑制与ROS信号放大
近期,一项发表于Autophagy杂志的研究(原研究由湖南大学王立明、中山大学卢盈颖及中南大学许浩东团队合作完成)深入探讨了PINK1蛋白和ROS在神经母细胞瘤细胞焦亡调控中的机制。研究发现,PINK1介导的线粒体自噬(Mitophagy)能够清除受损线粒体,降低有害ROS水平,从而帮助细胞存活。然而,该研究指出,在神经母细胞瘤细胞中,通过药物(如AC220)抑制PINK1或基因敲除PINK1,会显著损害线粒体自噬功能。
这一过程导致线粒体内ROS水平急剧升高。升高的ROS进一步引起线粒体外膜蛋白TOMM20的氧化和寡聚化,为后续的细胞死亡事件埋下伏笔。
关键机制解析:BAX-Caspase-GSDME通路如何被激活
研究团队详细阐述了抑制PINK1后诱导焦亡的具体通路:
- BAX激活:升高的ROS促使线粒体招募并激活促凋亡蛋白BAX。
- 细胞色素C释放:激活的BAX促进线粒体释放细胞色素C(CYCS)到细胞质中。
- Caspase-3激活:细胞质中的细胞色素C激活Caspase-3(CASP3)。
- GSDME裂解与焦亡执行:激活的Caspase-3切割Gasdermin E(GSDME)蛋白。被切割后的GSDME N端片段(GSDME-N)会寡聚化并在细胞膜上打孔,最终导致细胞内容物释放,发生焦亡。

GSDME在神经细胞中的作用
值得注意的是,GSDME在神经元细胞(如研究中使用的SH-SY5Y细胞系)中的表达水平相对较高。虽然GSDME介导的焦亡在黑色素瘤、结直肠癌等多种癌症中已有报道,但其在神经母细胞瘤中的具体作用和调控机制此前尚不完全清楚。这项研究填补了部分空白,揭示了**GSDME**在该肿瘤焦亡通路中的核心地位。
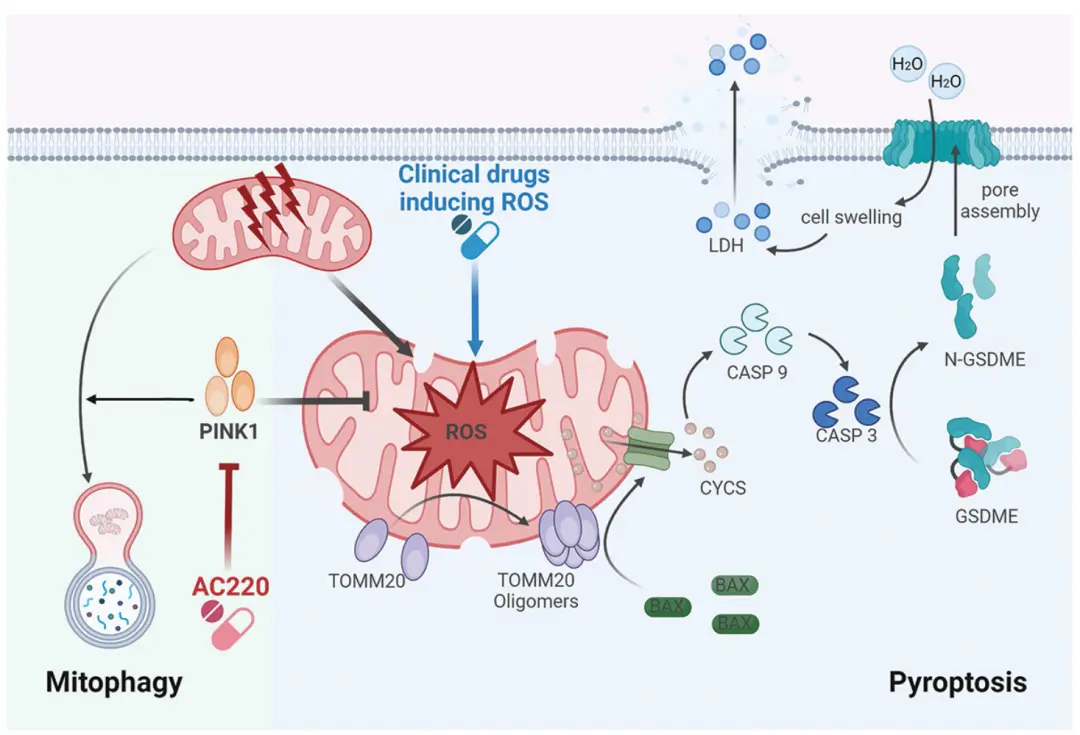
模式机理图(图片源自Autophagy)
治疗启示:靶向PINK1/ROS通路的潜力与展望
这项研究不仅揭示了神经母细胞瘤细胞焦亡的新机制,更重要的是,它提示了潜在的治疗策略。研究发现,抑制PINK1能够增强临床上已使用的ROS诱导药物——依他尼酸(Ethacrynic acid, EA)的抗肿瘤效果,在动物模型中有效抑制了神经母细胞瘤的进展。
这意味着,靶向PINK1或调控ROS水平可能成为治疗神经母细胞瘤,特别是对传统疗法不敏感的难治性神经母细胞瘤的一种有前景的干预手段。未来,开发特异性PINK1抑制剂或联合用药方案,有望为患者带来新的希望。对于寻求这类新兴治疗策略和靶向药物的患者,了解相关的药物信息、获取渠道及潜在的价格范围至关重要。MedFind致力于提供前沿的抗癌资讯(点击查看更多抗癌资讯)和便捷的海外药物代购服务。
结论:焦亡为神经母细胞瘤提供新思路
总而言之,该研究阐明了抑制PINK1通过放大ROS信号,激活BAX-Caspase-GSDME通路诱导神经母细胞瘤细胞焦亡的详细机制。这为理解肿瘤细胞死亡调控网络提供了新见解,并为开发针对神经母细胞瘤的创新疗法,特别是诱导焦亡的策略,开辟了新的方向。如果您对神经母细胞瘤的治疗方案或药物选择有疑问,可以尝试使用MedFind的AI问诊服务获取初步建议。