卵巢癌细胞在腹水中的存活能力是其发生腹膜转移的关键步骤。近日,中山大学的研究团队在Nature Communications上发表了一项重要研究,揭示了亚精胺/精胺N1-乙酰转移酶1(SAT1)在卵巢癌腹膜转移中的非经典作用。
该研究表明,SAT1蛋白不仅参与多胺代谢,还在卵巢癌细胞的锚定非依赖性存活和转移播散中发挥重要作用。研究发现,SAT1高表达的卵巢癌细胞更容易在腹水中存活,并且原发肿瘤中SAT1的高表达与患者腹膜转移率增加有关。从机制上讲,SAT1通过对多个有丝分裂调节基因的H3K27结构域进行非标准乙酰化,提高其转录水平,从而保护播散细胞免受异常有丝分裂和有丝分裂细胞死亡的影响。更重要的是,研究发现SAT1对H3K27的乙酰化依赖于谷氨酰胺的还原羧化来供应细胞核中的乙酰辅酶A。
在小鼠模型中,研究人员使用小分子抑制剂银杏内酯B抑制SAT1,结果显示转移性肿瘤负荷显著减轻。这一发现表明,SAT1抑制可能是一种有前景的转移性卵巢癌治疗策略。

卵巢癌是女性常见的恶性肿瘤之一,其特点是容易发生腹膜转移和复发。传统的治疗方法包括手术和化疗,但对于化疗耐药的患者,治疗选择非常有限。因此,深入了解卵巢癌的转移机制,寻找新的治疗靶点至关重要。
研究团队的发现为卵巢癌的治疗提供了新的思路。通过抑制SAT1蛋白的活性,有望抑制卵巢癌细胞的转移和扩散,从而改善患者的预后。如果您正在寻找卵巢癌相关的靶向药或仿制药,欢迎访问MedFind药品代购平台,我们提供专业的海外购药服务。
恶性腹水伴肿瘤细胞播散是卵巢癌转移和复发的重要特征。卵巢癌细胞能够在脱离细胞外基质(ECM)的情况下存活,并在腹膜腔内广泛播散,这种现象被称为锚定非依赖性存活。研究表明,锚定非依赖性存活与代谢重编程有关。SAT1在调节有丝分裂控制和染色体分离相关基因中的H3K27ac表观遗传标记方面发挥着非经典作用,从而促进了非锚着依赖性生存,并驱动卵巢癌细胞的腹膜播散。
这项研究最初旨在探讨代谢重编程在卵巢癌锚定非依赖性细胞存活和腹膜转移中的作用。研究结果表明,SAT1在调节对有丝分裂控制和染色体分离至关重要的基因中的H3K27ac表观遗传标记方面具有重要作用。这一机制促进了非锚着依赖性生存,并驱动卵巢癌细胞的腹膜播散。如果您对卵巢癌的治疗方案有疑问,欢迎使用MedFind AI问诊服务,获取个性化的医疗建议。
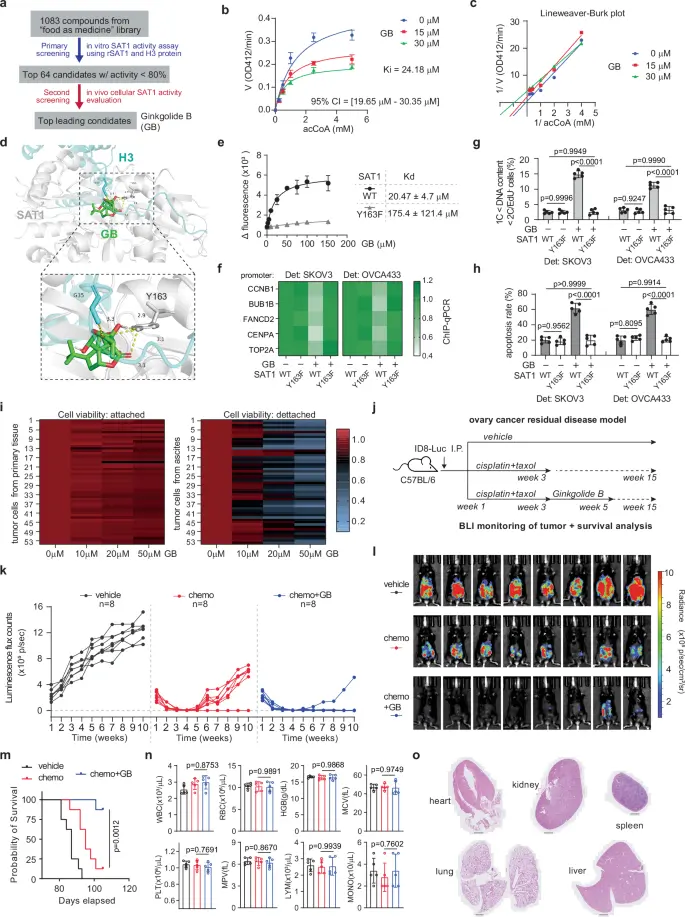
图1 银杏内酯B被鉴定为SAT1抑制剂,减少腹膜转移作为维持治疗(摘自Nature Communications)
如果您想了解更多关于卵巢癌靶向药、仿制药的信息,或者需要海外购药服务,请访问MedFind。我们致力于为癌症患者提供专业的药物信息和便捷的购药渠道。
参考消息:
https://doi.org/10.1038/s41467-025-58525-8