“医生,我的乳腺癌已经转移了,接下来该怎么办?”这句充满焦虑的提问,是无数晚期乳腺癌患者和家属心头的重担。特别是对于激素受体阳性(HR+)、HER2阴性(HER2-)晚期乳腺癌患者而言,这个诊断曾意味着漫长而充满不确定性的治疗旅程。作为最常见的乳腺癌亚型,它占据了所有晚期乳腺癌的60%-70%,其治疗效果和患者生活质量一直是医学界关注的焦点。然而,令人欣慰的是,随着医学科技的飞速发展,HR+/HER2-晚期乳腺癌的治疗策略正在发生革命性的转变,我们正告别过去“一刀切”的固定模式,迈入一个“量体裁衣”的精准医疗新时代。
2026年1月,《临床医师癌症杂志》(CA Cancer J Clin)发表了一篇重磅综述,为我们描绘了这一激动人心的治疗图景。该研究系统总结了当前对HR+/HER2-晚期乳腺癌生物学机制的深刻认识,特别是详细阐述了原发性和继发性耐药的复杂机制,包括驱动基因的变化。这些前沿的分子生物学发现,正与患者的临床特征相结合,共同指导着治疗方案的精准选择和治疗顺序的动态调整。这意味着,未来的治疗不再是简单的按部就班,而是像一场精心策划的“动态导航”,医生将根据肿瘤的实时变化,为每位患者找到最适合的“航线”,最大程度地延长生存期并提升生活质量。MedFind致力于帮助患者获取最新的抗癌资讯和药物信息,正是为了让患者和家属能更好地理解这些复杂的治疗理念,做出明智的决策。

HR+/HER2-晚期乳腺癌:挑战与希望并存
HR+/HER2-晚期乳腺癌,顾名思义,其癌细胞表面表达雌激素受体(ER)和/或孕激素受体(PR),但不表达HER2受体。这种亚型的乳腺癌通常对内分泌治疗敏感,因此内分泌治疗是其治疗的基石。然而,最大的挑战在于,几乎所有患者最终都会对内分泌治疗产生耐药,导致疾病进展。这种耐药性是限制治疗效果、影响患者长期生存的关键瓶颈。理解并克服耐药,是精准治疗的核心目标。
德克萨斯大学MD安德森癌症中心和贝勒医学院的专家团队正是基于这一挑战,系统梳理了HR+/HER2-晚期乳腺癌领域的最新进展。他们强调,治疗策略必须从固定的“食谱式”顺序,转变为动态调整的精准模式。这要求医生像经验丰富的舵手,根据“航海图”(生物标志物)和“洋流变化”(耐药机制演变),在整个疾病过程中不断调整治疗方向。因为肿瘤并非一成不变,而是在治疗压力下不断“进化”和“变异”。只有实时监测这种进化,才能始终领先一步,为患者争取更多生机。
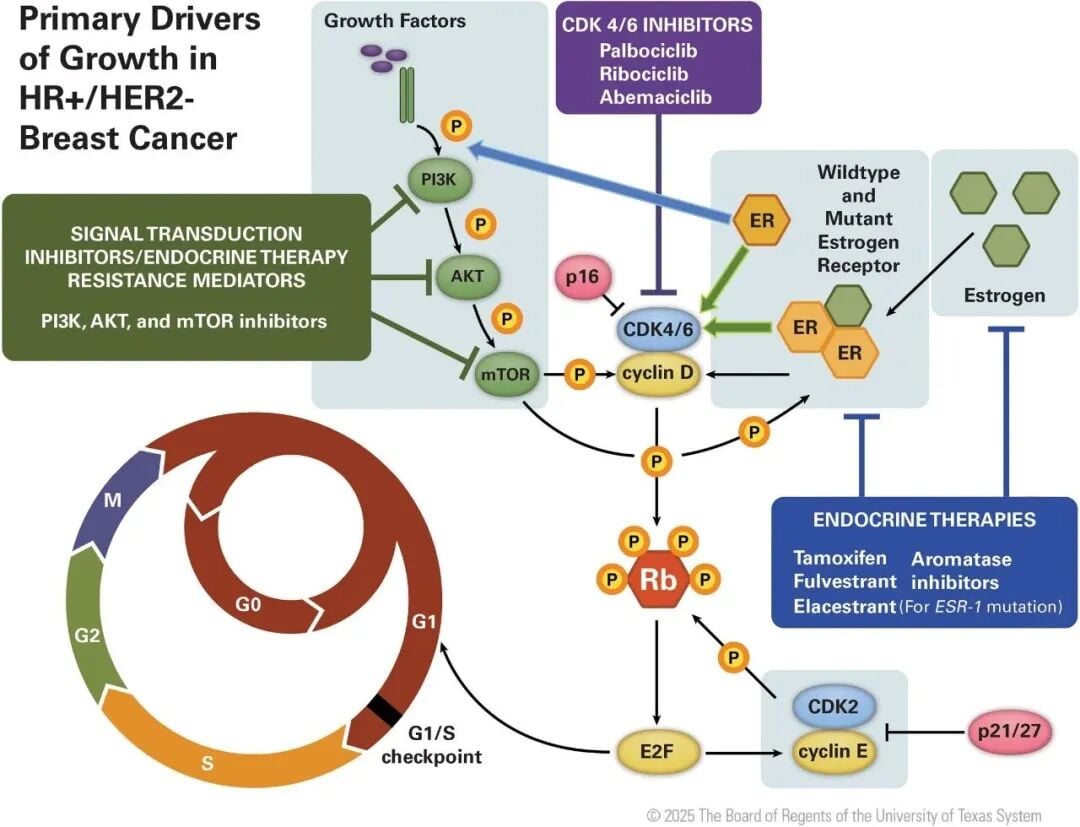
深度解析:内分泌治疗耐药的“幕后黑手”
内分泌治疗通过阻断雌激素对癌细胞的刺激作用来发挥疗效,是HR+/HER2-乳腺癌的基石。然而,癌细胞为了生存,会发展出各种“逃逸机制”,导致耐药。耐药通常分为两类:
- 原发耐药: 指患者在接受内分泌治疗的6个月内,疾病就出现进展。这通常意味着肿瘤细胞从一开始就对该治疗不敏感。
- 继发耐药: 指患者在接受内分泌治疗超过6个月后,疾病才出现进展。这表明肿瘤细胞在治疗过程中逐渐适应并产生了新的耐药机制。
这种区分对于后续治疗选择至关重要,因为不同类型的耐药可能需要不同的应对策略。主要的耐药机制包括:
1. ESR1基因突变:雌激素受体的“变形记”
ESR1基因编码雌激素受体(ER)。当ESR1基因发生突变时,ER的结构会发生改变,即使没有雌激素的存在,也能持续激活下游的生长信号通路,导致癌细胞不断增殖。这就像一个“锁芯”变形了,即使没有钥匙也能被打开,让癌细胞持续“生长”。对于存在ESR1突变的患者,传统的芳香化酶抑制剂效果会大打折扣,需要选择能够直接降解ER或阻断其活性的药物,例如新型口服雌激素受体降解剂(SERDs)如艾拉司群。
2. 旁路信号激活:PI3K-AKT-mTOR通路的“备用引擎”
癌细胞非常“狡猾”,当主要生长通路(如雌激素信号通路)被阻断时,它们会激活其他“备用引擎”来维持生长,其中最常见的就是PI3K-AKT-mTOR信号通路。这个通路在细胞生长、增殖、代谢和存活中扮演关键角色。当PIK3CA基因发生突变时,PI3K通路会被异常激活,绕过内分泌治疗的阻碍,驱动肿瘤生长。针对这一机制,PI3K抑制剂如阿吡利塞联合内分泌治疗,能有效阻断这个“备用引擎”,恢复治疗敏感性。
3. 细胞周期调控失控:CDK4/6抑制剂的“克星”
细胞周期是细胞生长和分裂的有序过程。CDK4/6抑制剂(如哌柏西利)通过阻断细胞周期中的关键环节,使癌细胞停止分裂。然而,当RB1基因缺失或突变时,细胞周期调控会失控,使得CDK4/6抑制剂无法发挥作用,导致耐药。此外,一些癌细胞还会通过激活其他细胞周期蛋白(如CDK2)来逃避CDK4/6抑制剂的作用。针对这类耐药,新型的CDK2抑制剂正在研发中,有望为患者带来新的希望。
4. 肿瘤微环境:癌细胞的“庇护所”
肿瘤并非孤立存在,它被周围的血管、免疫细胞、成纤维细胞等构成的“微环境”所包围。这个微环境可以为癌细胞提供营养、生长因子,甚至帮助它们逃避免疫系统的攻击和药物的作用。例如,某些免疫细胞或基质细胞会分泌因子,促进癌细胞的生长和耐药。未来的治疗需要更多地关注如何改造肿瘤微环境,使其不再成为癌细胞的“庇护所”。
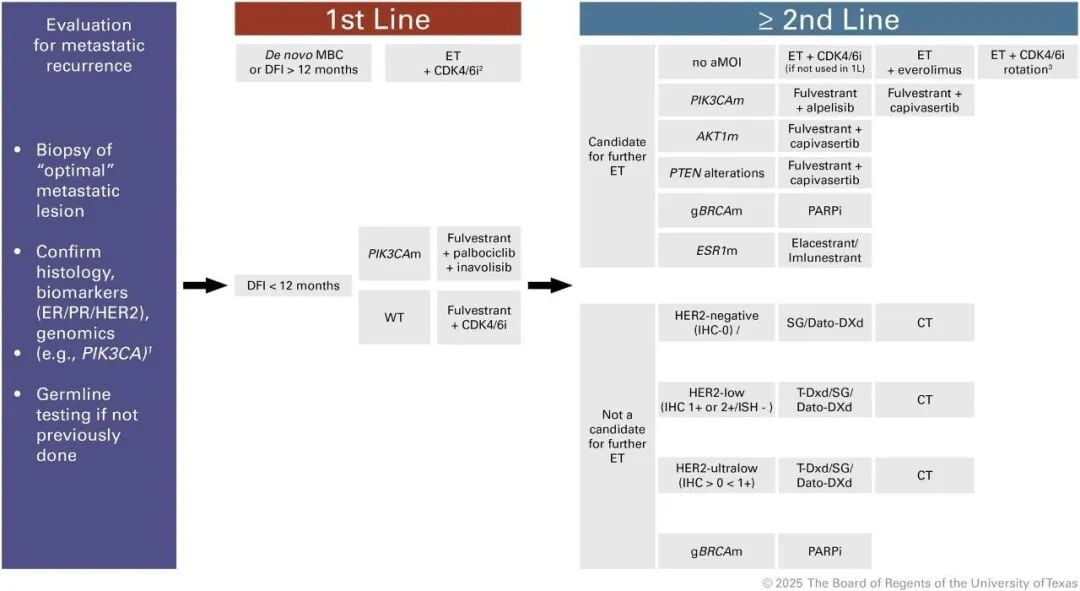
精准导航:生物标志物驱动的治疗路线图
在精准医疗时代,治疗决策不再是盲目试错,而是基于最新的生物标志物检测结果,为患者量身定制的“导航路线图”。
1. 一线治疗:内分泌治疗联合CDK4/6抑制剂的基石地位
目前,对于HR+/HER2-晚期乳腺癌的一线治疗,内分泌治疗联合CDK4/6抑制剂(如哌柏西利)仍是国际公认的标准方案。这种联合治疗显著延长了患者的无进展生存期(PFS),延缓了疾病进展。然而,SONIA研究提示我们,并非所有患者都需要在一开始就联合使用CDK4/6抑制剂。对于肿瘤负荷较低、疾病进展相对缓慢的患者,将CDK4/6抑制剂推迟至二线治疗,可能是一个合理的个体化选择,这有助于避免过早的药物毒性,并为后续治疗保留更多选择。但这一策略仍需在医生指导下,结合患者具体情况进行评估。
2. 疾病进展后:根据分子分型精准打击
当疾病在一线治疗后出现进展时,治疗选择会呈“树枝状”分化,关键在于需要再次进行活检(包括组织活检或液态活检)以获取最新的肿瘤分子信息。根据这些信息,医生可以精准选择后续治疗方案:
- PIK3CA突变: 如果检测到PIK3CA突变,那么选择PI3K抑制剂阿吡利塞联合氟维司群(一种选择性雌激素受体降解剂)是有效的策略。这种组合能够协同作用,更有效地抑制肿瘤生长。
- ESR1突变: 对于存在ESR1突变的患者,新型口服雌激素受体降解剂(SERDs)如艾拉司群显示出显著优势。它能有效降解异常的雌激素受体,恢复内分泌治疗的敏感性。氟维司群也是一种注射型SERD,在ESR1突变患者中同样有效。
- BRCA突变: 如果患者携带BRCA1或BRCA2基因突变,那么PARP抑制剂如奥拉帕利(点击查看购买渠道与价格)将是重要的治疗选择。PARP抑制剂通过“合成致死”机制,特异性地杀伤BRCA突变的癌细胞,为这部分患者带来了显著的生存获益。MedFind平台可以帮助患者了解更多关于奥拉帕利的用药详情和获取途径。
- HER2低表达: 即使是HER2阴性乳腺癌,其中仍有相当一部分患者表现为HER2低表达(免疫组化1+或2+且FISH阴性)。对于这类患者,抗体缀合药物(ADC)如德曲妥珠单抗(Trastuzumab deruxtecan)的出现,彻底改变了治疗格局。它像一个“精准制导导弹”,通过HER2靶点将化疗药物精确递送到癌细胞内部,在HER2低表达晚期乳腺癌中展现出惊人的疗效。
动态监测:开创治疗新纪元
精准医疗的精髓在于“动态”,而液态活检技术正是实现动态监测的“雷达”。
1. 液态活检实现实时监控
循环肿瘤DNA(ctDNA)检测技术,通过分析血液中游离的肿瘤DNA片段,能够像雷达一样实时监控肿瘤的分子演变。这意味着我们无需反复进行创伤性组织活检,就能及时了解肿瘤的“基因身份证”是否发生了变化,是否产生了新的耐药突变。
PADA-1研究是这一领域的典范:对于接受芳香化酶抑制剂联合哌柏西利治疗的患者,当ctDNA检测到新发ESR1突变,但影像学检查尚未显示疾病进展时,提前将芳香化酶抑制剂换用为氟维司群,可显著提高患者的无进展生存率(PFS)。这标志着治疗模式从“等待临床进展”向“提前分子干预”的重大转变。我们不再是被动等待疾病恶化,而是可以主动出击,在耐药早期就进行干预,从而延长患者的有效治疗时间。
2. 新型药物层出不穷:克服耐药的希望之光
为了应对癌细胞的耐药挑战,科学家们从未停止研发新的武器。新一代药物为克服耐药带来了新的希望:
- 新型口服雌激素受体降解剂(SERDs): 除了艾拉司群,还有如卡米司群(Camizestrant)等正在研发中。这些药物具有更好的药代动力学特性和更强的ER降解能力,有望进一步提高治疗效果。
- 蛋白质降解靶向嵌合体(PROTACs): 如韦普司群(Vepdegestrant)等,这类药物代表了药物研发的前沿。它们通过劫持细胞自身的蛋白质降解系统,特异性地降解目标蛋白(如雌激素受体),从而达到更彻底的抑制效果,有望克服传统抑制剂的耐药问题。
- CDK2抑制剂: 针对CDK4/6抑制剂耐药后,癌细胞可能通过激活CDK2来继续增殖的机制,CDK2抑制剂正在研发中,有望成为克服CDK4/6抑制剂耐药的重要手段。
- PI3K和mTOR双靶点抑制剂: 如吉达利塞(Gedatolisib)等,这类药物能够同时抑制PI3K和mTOR两个关键靶点,有望更全面地阻断PI3K-AKT-mTOR通路的异常激活,为PIK3CA突变患者提供更优的治疗选择。
3. 患者报告结局(PROs)备受重视
现代肿瘤治疗不仅追求生存时间的延长,更注重患者的生活质量。将患者的主观感受(如疼痛、疲劳、恶心、情绪等)纳入疗效评价和治疗决策,即“患者报告结局”(PROs),是实现真正以患者为中心的关键。医生在选择治疗方案时,不仅要考虑药物的疗效和安全性,还要充分听取患者的意见,平衡治疗效果和生活质量,让患者在抗癌的道路上走得更远、更有尊严。
结语:精准医疗的现在与未来
HR+/HER2-晚期乳腺癌的治疗已进入一个前所未有的精准时代。其核心策略可总结为:
- 以内分泌治疗为基石,CDK4/6抑制剂为首要强化手段,但需个体化考量。
- 疾病进展后,根据最新的分子分型结果,精准打击关键靶点。
- 积极采用抗体缀合药物(ADC)等新型武器,拓展治疗边界。
- 通过动态分子监测(如液态活检),实现治疗方案的实时调整和个体化优化。
总体而言,我们可以把晚期乳腺癌的治疗想象成一场持久而精密的“军事行动”:
- 传统战术: 按照固定的“食谱”顺序使用各种武器(药物)。
- 现代战术: 先派“侦察兵”(基因检测)了解“敌情”(肿瘤特性和耐药机制),然后选择最合适的“武器”,并在战斗中不断“侦察敌情变化”(动态监测),随时调整“战术”。
这条通往“与癌共存”的道路虽然漫长,但方向已经清晰:通过精准医疗,我们有望让晚期乳腺癌从一个致命性疾病,逐渐转变为像高血压、糖尿病一样的慢性病,实现长期管理,让患者拥有更长久、更高质量的生命。MedFind将持续关注全球抗癌前沿,为患者提供最新、最全面的药物信息和海外购药渠道,助力每位患者都能获得最适合自己的治疗方案,重拾生活的希望。
参考来源:
Singareeka Raghavendra A, Damodaran S, Barcenas CH, Fuqua SA, Layman RM, Tripathy D. Personalizing therapies over the course of hormone receptor-positive/HER2-negative metastatic breast cancer. CA Cancer J Clin. 2026 Jan-Feb;76(1):e70055. doi: 10.3322/caac.70055. PMID: 41524544; PMCID: PMC12794760.




![[乳腺癌治疗新突破] 安徽大学研制“双钥匙”光敏剂,精准狙击核DNA,转移性乳腺癌迎来新曙光 7 [乳腺癌治疗新突破] 安徽大学研制“双钥匙”光敏剂,精准狙击核DNA,转移性乳腺癌迎来新曙光](https://medfind.link/wp-content/uploads/2026/03/f793e7aeb20e6cff5ffc342093567ab2.jpg)
