血管母细胞瘤(Hemangioblastoma, HB)是一种起源于中枢神经系统的良性血管性肿瘤,虽然在WHO分类中属于1级,但由于其常发生于小脑、脑干或脊髓等关键部位,且血管丰富,手术切除难度大、风险高,术后复发率也较高,给患者带来了巨大的挑战。随着分子生物学研究的深入,基因检测已成为辅助诊断、评估遗传风险和指导靶向治疗的关键工具。
本文将基于一个同时检出 VHL 和 TSC2 体系/胚系变异的血管母细胞瘤病例,深度解析这两种基因变异在疾病诊断和遗传风险评估中的重要性,并重点介绍针对 VHL 突变驱动的肿瘤的创新靶向药物——HIF-2α 抑制剂贝组替凡(Belzutifan)的临床疗效、作用机制,以及患者关心的药物获取渠道和用药指导,旨在为血管母细胞瘤患者及其家属提供最新的治疗信息和选择。
血管母细胞瘤(HB)概述与传统治疗挑战
血管母细胞瘤是中枢神经系统肿瘤中相对罕见的一种,约占所有中枢神经系统肿瘤的不到2%。根据《2021年第5版WHO中枢神经系统肿瘤分类》,HB 被归类为间叶性非脑膜上皮来源肿瘤,属于 WHO 1级。这意味着它生长缓慢,恶性程度低。
然而,HB 的治疗复杂性主要源于其解剖位置。它常见于小脑,其次是脑干和脊髓。这些部位是维持生命功能的核心区域,肿瘤的血管异常丰富,使得手术成为一项高风险的挑战。尽管手术切除是主要的治疗手段,但对于无法完全切除或位于关键功能区的病灶,患者面临着致残甚至致死的风险,且术后复发仍是需要长期关注的问题。
HB 的发生机制与遗传因素密切相关。大部分 HB 是散发性的,但约有 30% 的病例与常染色体显性遗传病——希佩尔-林道综合征(Von Hippel-Lindau syndrome, VHL 综合征)相关。VHL 综合征患者通常发病年龄更早,且肿瘤多发,治疗难度更大。
基因检测在血管母细胞瘤诊断与风险评估中的核心价值
基因检测不仅能帮助确诊,还能区分散发性 HB 和遗传性 HB,从而对患者及其家属进行遗传风险评估和早期干预。在本案例中,患者同时检出 VHL 和 TSC2 基因变异,这提示了复杂的遗传背景。
VHL 基因变异:散发性与遗传性 HB 的主要驱动因素
VHL 基因是一种重要的肿瘤抑制基因,位于染色体 3p。研究表明,约 78% 的散发性 HB 患者都检测到了 VHL 基因的缺失或失活突变。VHL 蛋白的功能是泛素化并降解缺氧诱导因子(HIF)。当 VHL 基因失活时,HIF 蛋白(尤其是 HIF-2α)无法被降解,在细胞内大量积累,进而激活下游靶基因,如血管内皮生长因子(VEGF),导致血管过度增生,形成血管母细胞瘤。
WHO 分类指出,HB 的必要诊断标准包括:肿瘤组织由多空泡化的间质细胞和丰富的毛细血管网组成,且间质细胞免疫组化指标(如 inhibin)阳性,或检测到 VHL 基因失活突变,或确诊为 VHL 综合征患者。
对于 VHL 综合征相关的 HB,患者通常携带 VHL 基因的胚系(遗传性)变异。VHL 综合征是一种多系统受累的疾病,除了中枢神经系统血管母细胞瘤外,还可能累及肾脏(肾细胞癌)、胰腺(神经内分泌肿瘤)、肾上腺(嗜铬细胞瘤)等多个器官。因此,一旦确诊 VHL 胚系变异,患者及其亲属都需要进行全面的筛查和遗传咨询。
原始文章中的临床研究数据显示,在 32 例散发性血管母细胞瘤患者中,有 25 例(78%)检出了 VHL 基因失活变异,这进一步强调了 VHL 通路在 HB 发生中的核心地位。
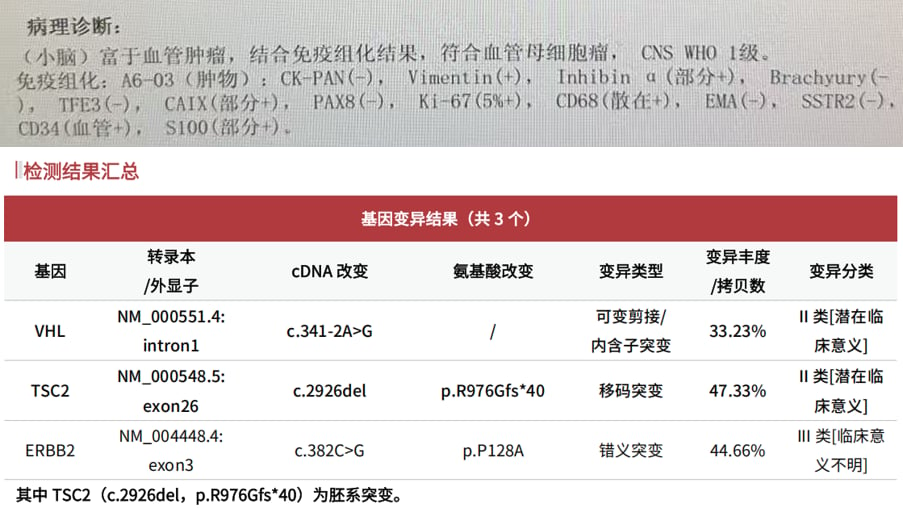
图1 血管母细胞瘤患者的病理诊断和基因检测结果

图2 WHO分类关于血管母细胞瘤的必要诊断标准
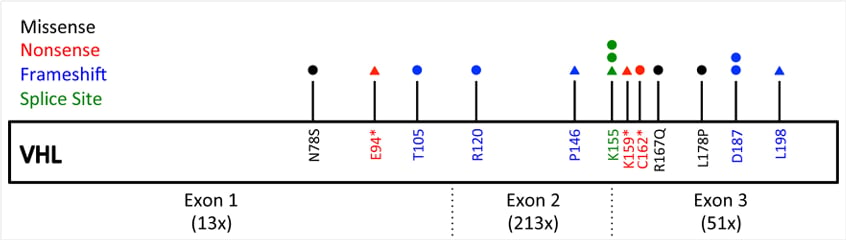
图3 32例散发性血管母细胞瘤患者检出VHL基因非同义突变分布

图4 散发性和遗传性血管母细胞瘤流行病学特征比较
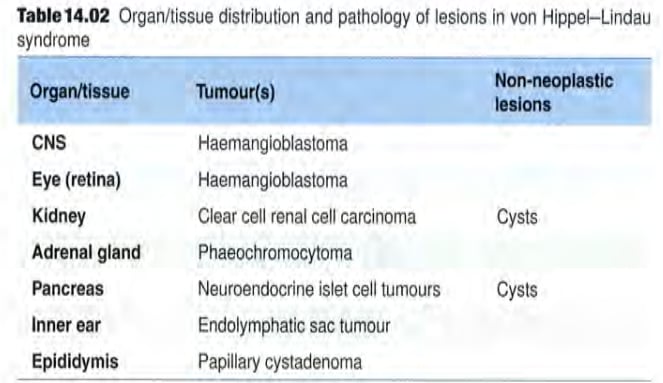
图5 VHL综合征受累的器官/组织分布及其临床表型
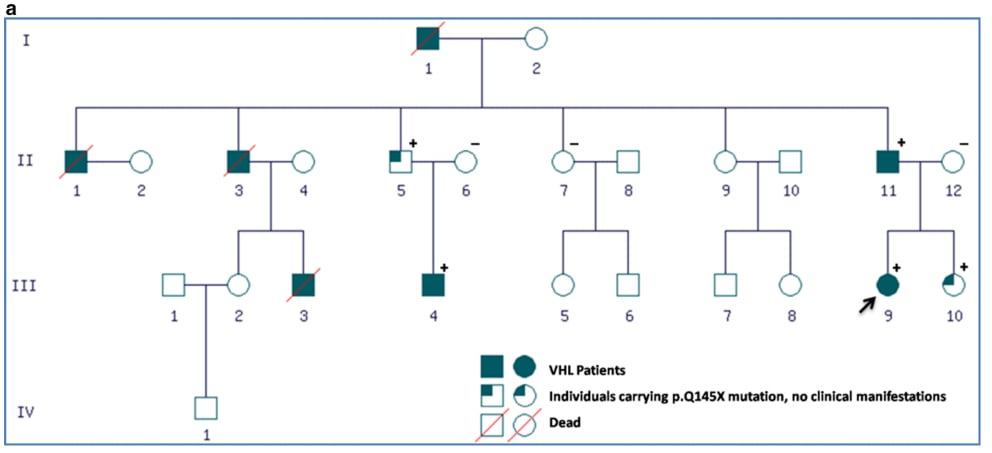
图6 VHL遗传病相关血管母细胞瘤患者家系图
TSC2 胚系变异:结节性硬化症与 HB 的关联
结节性硬化症(Tuberous Sclerosis Complex, TSC)是另一种常染色体显性遗传病,主要由 TSC1 或 TSC2 基因失活突变引起。TSC1/2 基因编码的蛋白(Hamartin 和 Tuberin)共同组成一个复合物,负责抑制 mTOR 信号通路。当 TSC1/2 失活时,mTOR 信号通路过度激活,导致细胞异常增殖和分化,形成错构瘤和良性肿瘤。
本案例患者检出 TSC2 基因胚系杂合有害变异,提示其同时罹患结节性硬化症。虽然 HB 主要与 VHL 相关,但文献报道 TSC1/2 变异也可能导致血管母细胞瘤的发生发展,包括肾血管母细胞瘤和胰腺血管母细胞瘤。因此,对于检出 TSC2 变异的 HB 患者,需要警惕 TSC 相关的多器官受累,如脑室管膜下巨细胞星形细胞瘤(SEGA)、肾血管平滑肌脂肪瘤(AML)等。
《2019罕见病诊疗指南》明确指出,基因检测是 TSC 的诊断标准之一,正常组织 DNA 中检出 TSC1 或 TSC2 基因病理性突变足以确诊。对于这类患者,除了 VHL 通路靶向药外,mTOR 抑制剂如依维莫司(Everolimus)也可能成为潜在的治疗选择,因为依维莫司正是针对 TSC 驱动的 mTOR 信号通路过度激活。

图7 指南关于结节性硬化症的基因诊断标准
靶向治疗新突破:贝组替凡的作用机制与临床疗效
对于无法手术或复发的血管母细胞瘤,尤其是 VHL 相关的病灶,靶向治疗提供了新的希望。贝组替凡(Belzutifan,商品名 Welireg)是近年来获批用于治疗 VHL 病相关肿瘤的创新药物,它直接针对 VHL 基因失活导致的下游驱动因素。
HIF-2α 抑制剂:贝组替凡如何精准打击 VHL 相关肿瘤
如前所述,VHL 基因失活导致 HIF 蛋白积累。在 VHL 相关的肿瘤中,HIF-2α 被认为是主要的致癌驱动因子。贝组替凡的作用机制是作为一种高选择性的 HIF-2α 抑制剂,它能够阻断 HIF-2α 与其伴侣蛋白 HIF-1β 的相互作用,从而阻止 HIF-2α 靶基因(如 VEGF、GLUT1、Erythropoietin 等)的转录和表达。通过抑制这些促进血管生成和细胞增殖的信号,贝组替凡能够有效阻止肿瘤生长,甚至导致肿瘤缩小。
贝组替凡已获得中国国家药品监督管理局(NMPA)批准,用于治疗不需要立即手术治疗的 VHL 病相关肾细胞癌、中枢神经系统血管母细胞瘤或胰腺神经内分泌肿瘤成人患者。这一批准标志着 HB 治疗进入了分子靶向时代。
LITESPARK-004 临床试验数据解读
贝组替凡的获批主要基于 LITESPARK-004 这项关键的单臂 II 期临床试验。该试验入组了 VHL 相关肿瘤患者,其中包含 61 例中枢神经系统血管母细胞瘤患者。中位随访时间长达 38 个月,结果显示出令人鼓舞的疗效:
- 客观缓解率(ORR):对于采用疗效评估方式 1 的 50 例患者,客观缓解率(ORR)达到 44%(22/50)。对于采用疗效评估方式 2 的 25 例患者,ORR 更是高达 76%(19/25)。
- 持续缓解时间(DOR):中位持续缓解时间均未达到,表明患者的缓解持续时间长久。
这些数据强有力地证明了贝组替凡在 VHL 相关中枢神经系统血管母细胞瘤治疗中的显著疗效和持久性。对于那些因肿瘤位置特殊而无法进行手术的患者,贝组替凡提供了一个有效的、非侵入性的治疗选择。
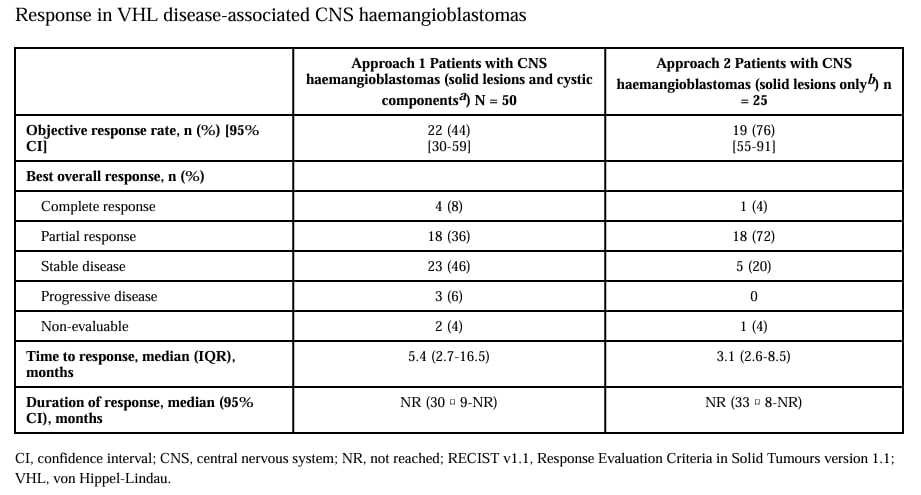
图8 VHL相关中枢神经系统血管母细胞瘤患者贝组替凡靶药治疗疗效
贝组替凡在散发性 HB 中的应用潜力
虽然贝组替凡主要针对 VHL 综合征患者获批,但由于大多数散发性 HB 也存在 VHL 基因失活,因此理论上散发性 HB 患者也可能从贝组替凡治疗中获益。
近期有案例报道,一名 17 岁女性确诊为中枢神经系统血管母细胞瘤,尽管 NGS 检测未发现 VHL 胚系变异(提示为散发性),且放疗后病灶仍增大,但在接受贝组替凡治疗 3 个月后,MRI 提示病灶明显缩小,水肿减少。这表明,只要肿瘤的驱动机制是 VHL/HIF-2α 通路失调,无论是否为遗传性 VHL 综合征,贝组替凡都有可能发挥作用。这为临床医生在处理散发性、难治性 HB 病例时提供了重要的治疗思路。

图9 该中枢神经系统肿瘤患者NGS并未检出VHL胚系变异
依维莫司在结节性硬化症相关 HB 中的潜在作用
对于本案例中同时检出 TSC2 胚系变异的患者,除了 VHL 相关的靶向治疗外,针对 TSC 驱动通路的治疗也值得关注。
TSC 基因失活导致 mTOR 信号通路过度活跃。依维莫司(Everolimus)是一种口服的 mTOR 抑制剂,已被广泛用于治疗 TSC 相关的多种病变,如 SEGA 和肾血管平滑肌脂肪瘤(AML)。虽然依维莫司在 HB 治疗中的直接数据不如贝组替凡充分,但鉴于 TSC2 变异与部分血管母细胞瘤的发生相关,如果患者的 HB 表现出对 VHL 抑制剂不敏感或同时存在其他 TSC 相关的严重病变,依维莫司可能作为联合治疗或替代治疗的潜在选择。
临床实践中,对于同时存在 VHL 和 TSC 变异的复杂病例,医生需要根据患者的具体肿瘤类型、位置和症状,权衡 HIF-2α 抑制剂和 mTOR 抑制剂的利弊,制定个性化的治疗方案。基因检测结果为这种复杂的决策提供了关键的分子基础。
如何获取贝组替凡等创新靶向药物?(价格与渠道)
对于血管母细胞瘤患者而言,贝组替凡等创新靶向药物的出现极大地改善了预后。然而,由于这些新药通常首先在欧美或中国香港等地上市,患者在内地获取和支付方面可能面临挑战。
贝组替凡(Belzutifan)作为一种相对较新的靶向药,其价格和可及性是患者和家属普遍关心的问题。目前,患者主要通过以下几种途径获取这类海外创新药物:
- 国内获批与医保:关注国家药监局的审批进度和医保谈判结果。一旦进入医保,将大幅减轻患者的经济负担。
- 临床试验:参与相关的临床试验是免费获取药物的重要途径,但需要符合严格的入组标准。
- 海外代购与国际直邮:对于国内尚未上市或价格高昂的药物,许多患者选择通过可靠的国际医疗服务平台,如 MedFind,获取海外原研药。这种国际直邮代购服务能够确保药物的真实性和合规性,为患者提供及时且便捷的用药选择。
在考虑海外用药时,患者应充分咨询专业医生,了解药物的适应症、剂量、潜在副作用以及最新的临床数据。同时,选择正规、专业的渠道获取药物至关重要,以确保用药安全和治疗效果。
为了帮助患者更好地理解复杂的基因检测报告和治疗方案,MedFind 平台提供了AI 辅助问诊服务,能够对 VHL、TSC2 等基因变异的意义进行专业解读,并结合患者的病情提供个性化的治疗建议。
此外,对于需要了解更多关于血管母细胞瘤治疗方案、最新临床研究进展以及药物价格信息的患者,可以通过 MedFind 的药物信息与指南资讯板块获取权威、准确的医学知识,从而做出最适合自己的治疗决策。
总结与展望
中枢神经系统血管母细胞瘤的治疗正在从单纯的手术和放疗,向基于分子机制的精准靶向治疗迈进。本案例突显了基因检测在 HB 诊疗中的多重价值:
- 辅助诊断:VHL 基因失活变异是 HB 诊断的重要分子依据。
- 遗传风险评估:胚系 VHL 或 TSC2 变异提示患者罹患 VHL 综合征或结节性硬化症,需对患者及其家属进行遗传咨询和多器官筛查。
- 指导靶向治疗:HIF-2α 抑制剂贝组替凡为 VHL 驱动的 HB 提供了高效且持久的治疗选择,尤其适用于无法手术的病灶。
随着更多靶向药物的研发和临床数据的积累,未来血管母细胞瘤患者的预后有望得到进一步改善。患者应积极与医生沟通,利用基因检测等先进技术,争取最优化、最精准的治疗方案。
参考文献:
[1]徐立新, et al. “散发性与von Hippel-Lindau综合征相关性颅内血管母细胞瘤的临床特征与生存结局分析.” 中国脑血管病杂志22.07(2025):439-452.
[2]张超才等. “中枢神经系统血管母细胞瘤的临床特征与治疗策略研究.” 临床神经外科杂志(2021).
[3]WHO Classification of Tumours Editorial Board. WHO classification of tumours. Central nervous system tumours [M]. 5th ed. Lyon: IARC Press, 2021.
[4]Shankar, Ganesh M et al. “Sporadic hemangioblastomas are characterized by cryptic VHL inactivation.” Acta neuropathologica communications vol. 2 167. 24 Dec. 2014, doi:10.1186/s40478-014-0167-x
[5]Yoda, Rebecca A, and Patrick J Cimino. “Neuropathologic features of central nervous system hemangioblastoma.” Journal of pathology and translational medicine vol. 56,3 (2022): 115-125. doi:10.4132/jptm.2022.04.13
[6]罗涛,王曲,王超,等.中枢神经系统血管母细胞瘤一家系的流行病学调查[J].临床神经外科杂志, 2017, 14(1):4.DOI:10.3969/j.issn.1672-7770.2017.01.012.
[7]Zhang, Qing et al. “Clinical presentation and mutation analysis of VHL disease in a large Chinese family.” Journal of neuro-oncology vol. 125,2 (2015): 369-75.
[8]《罕见病诊疗指南(2019年版)》
[9]Zheng, Aiping et al. “Primary hemangioblastoma of rectum: a rare case report and review of literature.” Journal of cancer research and clinical oncology vol. 151,12 322. 15 Nov. 2025, doi:10.1007/s00432-025-06366-9
[10]Iliopoulos, Othon et al. “Belzutifan for patients with von Hippel-Lindau disease-associated CNS haemangioblastomas (LITESPARK-004): a multicentre, single-arm, phase 2 study.” The Lancet. Oncology vol. 25,10 (2024): 1325-1336. doi:10.1016/S1470-2045(24)00389-9
[11]Newton, Braeden D et al. “Regression of sporadic CNS hemangioblastomas with belzutifan.” Journal of neuro-oncology vol. 175,2 (2025): 897-899. doi:10.1007/s11060-025-05161-3