癌症的发生往往源于细胞内部指令的混乱,而这些指令的核心就是基因表达。基因表达是一个极其复杂且精密的生物学过程,任何微小的偏差都可能导致细胞失控生长,最终形成肿瘤。长期以来,科学家们将DNA的包装结构——核小体(Nucleosome)——视为基因表达过程中的“绊脚石”或障碍。然而,一项发表于权威期刊《Science》的最新研究,颠覆了这一传统认知,证实核小体不仅不是障碍,反而是基因表达的“神助攻”,它通过缓解DNA的扭转应力,确保遗传信息的准确解码。这一基础性发现,为我们理解癌症等重大疾病的根源,以及未来开发靶向基因表达调控的肿瘤治疗新策略,提供了至关重要的线索。
基因表达的核心:DNA转录与“扭转危机”
要理解核小体的关键作用,我们首先需要了解基因表达的中心环节——转录(Transcription)。
什么是转录?为什么它对细胞至关重要?
DNA就像一本储存着生命全部信息的“说明书”。转录就是将DNA上的遗传信息,复制到信使RNA(mRNA)上的过程。随后,mRNA会将这些信息传递给细胞的蛋白质合成工厂,指导合成各种功能性蛋白质。如果转录过程出现错误或受阻,细胞就无法制造出正确的蛋白质,轻则功能受损,重则引发疾病,例如癌症。
RNA聚合酶的挑战:DNA的“紧绳效应”
在转录过程中,负责读取DNA信息的“马达酶”——RNA聚合酶(RNA Polymerase)——会沿着DNA双螺旋缓慢移动。为了读取信息,聚合酶必须解开DNA的双螺旋结构。这个过程类似于解开一根紧紧缠绕的绳子:你解开的部分越多,其余未解开的部分就会变得越紧。在分子层面,这种“越解越紧”的现象被称为扭转应力(Torsional Stress),它会导致DNA形成超螺旋(Supercoiling)。
这种扭转应力对RNA聚合酶的进程构成了巨大的阻碍。聚合酶不仅要克服物理障碍,还要旋转以追踪DNA螺旋,这些旋转进一步加剧了应力。如果应力得不到释放,转录就会停滞,基因表达就会失败。
科学新发现:核小体如何成为“扭转缓冲器”
核小体是构成染色质(Chromatin)的基本结构单元,由一段DNA缠绕在八个组蛋白分子上形成。在过去,核小体被简单地视为阻碍RNA聚合酶前进的物理路障。

康奈尔大学的创新工具与实验发现
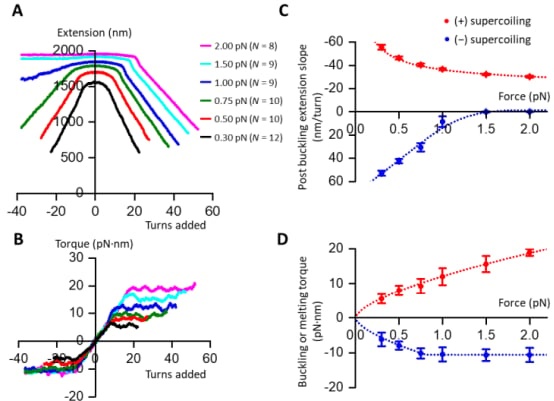
康奈尔大学的Michelle Wang教授团队利用他们开发的创新工具——角度光学阱和磁镊子——在分子尺度上精确地拉伸和超螺旋DNA,并测量扭矩和角度取向。经过数十年的基础研究,他们终于揭示了核小体的真正作用。
左手螺旋与右手螺旋的协同作用
关键在于DNA和核小体的“手性”:
- DNA的双螺旋: 天然向右扭曲(右手方向)。
- 核小体包裹DNA: 以左手方向包裹DNA,就像一个螺旋楼梯。
研究人员发现,正是这种相反的手性,使得核小体在转录过程中发挥了至关重要的作用。当RNA聚合酶在DNA上移动并产生右手扭转应力时,核小体左手方向的包裹结构能够有效地吸收和缓冲这些应力。
Wang教授表示:“随着聚合酶向前移动,染色质成为了一个扭转缓冲器。它释放了这种应力,使转录得以继续前进。这一发现展示了复杂的生物功能如何从生物分子的简单物理特性中产生。”
拓扑异构酶的辅助角色
除了核小体外,转录的成功还需要另一种酶的帮助——拓扑异构酶(Topoisomerases)。这些酶就像分子剪刀:它们在DNA上制造临时的切口,以释放积累的扭转应力,然后迅速将断裂处重新连接起来。核小体和拓扑异构酶共同作用,确保了DNA转录过程的顺利进行。
基础研究对癌症治疗的深远意义
这项关于核小体作为“扭转缓冲器”的发现,不仅仅是基础生物学上的突破,它对癌症研究和治疗具有直接且深远的意义。
基因表达异常是肿瘤发生的驱动力
癌症的本质是细胞周期和生长的失控,而这种失控往往源于关键基因表达的异常。例如:
- 抑癌基因(Tumor Suppressor Genes): 如果这些基因的表达被抑制(转录受阻),细胞就失去了刹车机制。
- 原癌基因(Oncogenes): 如果这些基因的表达被过度激活(转录过于顺畅),细胞就会持续加速分裂。
如果核小体或拓扑异构酶的功能发生异常,导致DNA扭转应力无法被有效管理,那么转录过程就会失衡,从而引发异常的细胞生长和癌症发展。
靶向转录调控的抗癌新策略
近年来,肿瘤治疗领域越来越关注“表观遗传学”(Epigenetics)和转录调控。许多新型抗癌药物正是通过影响这些机制来发挥作用。理解核小体如何调控扭转应力,有助于开发更精准、更有效的靶向药物。
1. 靶向拓扑异构酶的药物
拓扑异构酶在癌症治疗中早已是成熟的靶点。例如,常用的化疗药物如伊立替康(Irinotecan)和依托泊苷(Etoposide),就是通过抑制拓扑异构酶的功能,阻止癌细胞DNA复制和修复,从而达到杀伤肿瘤的目的。这项新研究进一步强调了拓扑异构酶在缓解转录应力中的关键作用,可能指导我们设计出副作用更小、疗效更佳的新一代拓扑异构酶抑制剂。
2. 靶向染色质重塑的药物
核小体不是固定不变的。细胞内存在着复杂的染色质重塑复合体,它们可以移动、修饰或移除核小体,从而控制基因的可及性。如果能够精准地调控这些重塑过程,使其恢复正常的基因表达模式,就有可能逆转癌细胞的恶性表型。
研究人员指出,未来的研究方向之一就是探索“核小体修饰和重塑如何改变染色质的机械特性,从而改变聚合酶通过核小体的方式”。这为开发新型表观遗传药物提供了理论基础。
为精准医疗提供基础支撑
对于正在寻求最新治疗方案的癌症患者和家属来说,了解这些基础研究的进展至关重要。虽然这项研究本身不涉及具体的抗癌药物,但它构成了所有靶向治疗和免疫治疗的底层逻辑。只有深入理解基因表达的调控机制,才能设计出真正高效、低毒的精准医疗方案。
如果您正在面临复杂的癌症治疗选择,或需要了解最新的靶向药物和治疗方案,可以利用专业的AI辅助问诊服务,获取个性化的治疗信息和建议。
展望未来:从机制到临床的转化
这项研究的成功,依赖于先进的生物物理学工具和跨学科的合作。它提醒我们,许多复杂的生物功能,可能源于生物分子简单而优雅的物理特性。
尽管我们已经知道核小体是扭转缓冲器,但关于基因表达的谜题仍有很多待解。例如,不同类型的核小体修饰(如组蛋白乙酰化、甲基化)是否会改变这种缓冲能力?在不同的癌症类型中,这种扭转应力管理机制是否会有特定的缺陷?
随着研究的深入,科学家们将能够更全面地描绘出基因表达调控的精细图景。未来,针对这些基础机制的干预,有望成为攻克癌症的有力武器。对于患者而言,及时了解全球前沿的药物信息、治疗方案解读与临床研究资讯,是做出最佳治疗决策的关键。
MedFind致力于追踪全球最新的医学突破,帮助患者及其家属获取可靠的药物信息和治疗渠道。如果您对海外上市的创新抗癌药物,如靶向基因表达调控的药物,感兴趣,可以进一步了解国际抗癌药品代购与直邮服务,确保治疗的连续性。
参考文献:
Jin Qian et al, Chromatin buffers torsional stress during transcription, Science (2025). DOI: 10.1126/science.adv0134.