创新药物LP-184:靶向DDR缺陷的精准抗癌新策略
对于经历多线标准治疗失败的晚期实体瘤患者而言,新的、有效的治疗方案是他们最大的希望。近日,一款名为LP-184的创新药物候选者,在针对晚期实体瘤患者的1/2期剂量递增/队列扩展研究(NCT05933265)中,公布了积极的1a期临床数据。该研究成功达到了所有主要终点,包括药物的安全性、耐受性以及推荐的2期剂量(RP2D)的确定,并初步展现了令人鼓舞的早期疗效信号。
LP-184是一种新一代的酰富烯(acylfulvene)类药物,其独特之处在于它是一种“生物标志物激活”的前药。它通过其“合成致死”(Synthetic Lethality)的作用机制,选择性地靶向存在DNA损伤修复(DDR)缺陷的实体瘤细胞。该药物的激活依赖于肿瘤细胞中高表达的PTGR1酶,激活后的代谢产物能精确地破坏癌细胞的DNA,同时对正常组织的影响较小。 这种精准的打击方式,为那些携带特定基因突变(如BRCA1、ATM、CHEK2等)的难治性癌症患者,提供了新的海外用药选择。
什么是DNA损伤修复(DDR)缺陷与合成致死?
为了维持基因组的稳定,人体细胞进化出了一套复杂的DNA损伤修复(DDR)系统。DDR系统包含多种修复通路,如同源重组修复(HRR)、核苷酸切除修复(NER)等。然而,在许多癌症中,由于基因突变(例如BRCA1/2、ATM、CHEK2等基因的改变),DDR系统会发生缺陷,导致癌细胞的基因组变得极不稳定,这也是癌症的标志之一。
“合成致死”是一种巧妙的抗癌策略。它指的是两个基因或通路,单独被抑制时细胞仍能存活,但同时被抑制时会导致细胞死亡。在LP-184的案例中,癌细胞本身已经存在DDR缺陷(相当于一个通路被“抑制”),而LP-184作为一种DNA烷化剂,通过PTGR1酶激活后对DNA造成损伤(相当于“抑制”了另一个修复通路)。对于DDR功能正常的细胞,它们可以修复LP-184造成的损伤而存活;但对于DDR缺陷的癌细胞,它们无法修复损伤,最终走向死亡。 这种机制的成功应用,最著名的例子就是PARP抑制剂在BRCA突变卵巢癌中的应用。LP-184的作用机制被认为可能比PARP抑制剂具有更广泛的适用性,因为它不仅对HRR缺陷肿瘤有效,对核苷酸切除修复(NER)缺陷肿瘤也显示出活性,甚至在对PARP抑制剂耐药的肿瘤模型中仍能保持活性。
1/2期临床试验数据积极:重度预处理患者的持久疗效
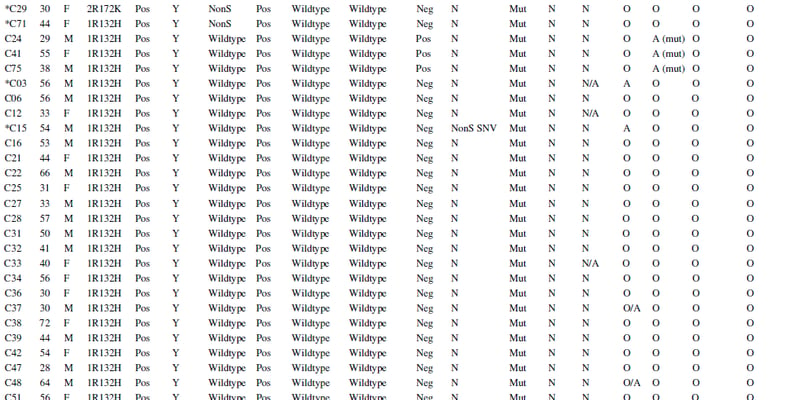
这项开放标签的1/2期研究主要招募了晚期复发/难治性实体瘤患者,这些患者通常已用尽标准治疗手段。在已完成的1a期剂量递增部分中,共有63名患者入组,其中许多患者存在DDR基因改变和/或PTGR1酶的过表达。值得注意的是,这些患者平均接受了3线或更多的既往治疗,属于治疗难度极高的群体。
关键疗效指标与持久临床获益
在疗效方面,研究观察到了令人鼓舞的早期信号:
- 疾病控制率(DCR):在DDR改变的肿瘤患者中,疾病控制率(DCR)达到了54%。DCR是指达到完全缓解(CR)、部分缓解(PR)或疾病稳定(SD)的患者比例,这对于多线治疗失败的晚期患者而言,是一个重要的积极信号。
- 临床获益率(CBR):在DDR改变的肿瘤患者中,6个月或更长时间的临床获益率(CBR)为8%。 在可评估的患者(n=21)中,有48%的患者在达到或超过治疗剂量阈值后获得了临床益处。
- 持久缓解案例:研究中报告了多名患者获得了持久的临床益处。例如,一名携带ATM突变的IV期胃肠道间质瘤(GIST)女性患者,在4线治疗失败后接受LP-184治疗,持续获益超过12个月,肿瘤缩小9%。此外,携带IV期BRCA1突变鳞状肺癌、CHEK2突变胸腺癌和ATM突变GIST的患者,在接受治疗12至23个月后,仍持续获得临床益处和有意义的肿瘤缩小。 一名带有DDR突变的非小细胞肺癌(NSCLC)患者,在免疫治疗进展后,使用LP-184获得了近两年的临床获益,并仍在持续治疗中。
这些在基因组筛选的终末期癌症患者中观察到的持久疗效,不仅令人鼓舞,也验证了药物开发商Lantern Pharma的RADR AI平台和PTGR1生物标志物的预测能力。 患者和家属可以通过MedFind获取最新的药物信息、治疗方案解读和临床研究资讯,为治疗决策提供支持。
安全性与药代动力学:可控的副作用与宽广的治疗窗口
安全性与耐受性是早期临床试验的首要目标。LP-184在重度预处理的晚期实体瘤患者中表现出良好的耐受性和有利的安全性特征,成功达到了安全性主要终点。
- 常见不良事件(AEs):最常见的不良反应包括恶心、呕吐、血小板减少症和可逆性转氨酶升高。这些不良事件在临床上均可控,且与该类药物已知的毒性特征一致。 在大多数剂量组中,未观察到剂量限制性毒性(DLTs),因药物相关不良事件导致的停药、延迟或中断率极低,多数不良事件为1级或2级,突显了其良好的耐受性。
- 推荐2期剂量(RP2D):研究确定了LP-184的RP2D为0.39 mg/kg,在每个21天周期的第1天和第8天进行静脉(IV)输注。最大耐受剂量(MTD)未报告。
- 治疗窗口:药代动力学数据显示,在低于RP2D的3个剂量水平下即可达到治疗所需的血浆浓度,这表明该药物具有约2.45倍的宽广治疗窗口,为后续的剂量优化和联合用药提供了充足的安全余地。
- 生物标志物验证:在1a期患者中,超过87%的患者达到了PTGR1生物激活阈值,进一步证实了PTGR1作为患者筛选生物标志物的实用价值。
良好的安全性和耐受性,使得LP-184无论是作为单药还是与其他药物(如PARP抑制剂或免疫疗法)联合使用,都具备了优越的评估基础。
未来开发计划:多癌种、多联用方案的精准布局
基于1a期临床试验的积极发现,Lantern Pharma公司计划推进LP-184进入多项以生物标志物为导向的1b/2期精准临床试验,目标适应症涵盖了具有巨大未满足临床需求的癌症类型。
单药与联合治疗的探索
未来的临床试验将包括:
- 单药治疗:在三阴性乳腺癌(TNBC)和晚期尿路上皮癌(Urothelial Cancer,即膀胱癌)中进行LP-184单药治疗的探索。
- 联合治疗:
- 在非小细胞肺癌(NSCLC)中,探索LP-184与免疫检查点抑制剂nivolumab(欧狄沃,Opdivo)和ipilimumab(伊匹木单抗,Yervoy)的联合用药方案。
- 在复发性胶质母细胞瘤(Glioblastoma)中,探索LP-184与spironolactone(螺内酯,Aldactone)的联合用药方案。
- 其他DDR缺陷肿瘤:研究还将继续在其他具有已知DDR基因组改变的实体瘤患者中,探索LP-184的疗效。
这些靶向性的临床试验,旨在通过精准的生物标志物筛选,最大化药物的疗效,并为患者提供最合适的治疗方案。对于晚期癌症患者,获取前沿的、尚未在国内上市的药物至关重要。MedFind提供抗癌药品代购与国际直邮服务,确保患者能够及时用药。
FDA的快速通道与孤儿药认定
值得一提的是,LP-184已获得美国食品药品监督管理局(FDA)的多项重要资格认定,这凸显了其在治疗难治性癌症方面的巨大潜力:
- 快速通道资格(Fast Track Designation):针对胶质母细胞瘤和三阴性乳腺癌。快速通道资格旨在加速用于治疗严重疾病并具有满足未满足医疗需求潜力的药物的开发和审评。
- 孤儿药资格(Orphan Drug Designation):针对胰腺癌、恶性胶质瘤和非典型畸胎样横纹肌瘤(ATRT)。孤儿药资格旨在鼓励开发用于治疗罕见疾病的药物。
结语:为晚期癌症患者带来新的希望
LP-184的1a期临床数据为晚期实体瘤患者,尤其是那些携带DDR缺陷且已用尽标准治疗选择的患者,带来了新的希望。该药物独特的PTGR1激活机制和合成致死策略,使其在精准肿瘤治疗领域占据了重要的位置。随着多项1b/2期临床试验的启动,我们期待LP-184能够进一步验证其疗效和安全性,并最终成为治疗三阴性乳腺癌、非小细胞肺癌、胶质母细胞瘤等多种难治性癌症的重要武器。
在复杂的抗癌治疗旅程中,患者需要及时了解前沿的临床研究进展和药物信息。MedFind致力于为患者提供AI辅助问诊服务,帮助他们更好地理解复杂的治疗方案、评估海外用药选择,并为他们的治疗决策提供信息支持。
LP-184的持续开发,是精准肿瘤学领域的一个重要里程碑,预示着未来癌症治疗将更加依赖于基因组生物标志物的指导,实现真正的个体化治疗。
- Lantern pharma reports additional positive LP-184 phase 1a results showing durable disease control in heavily pre-treated advanced cancer patients as company advances precision oncology program into multiple biomarker-guided phase 1b/2 trials. December 3, 2025. Accessed December 4, 2025.
- Study of LP-184 in patients with advanced solid tumors. ClinicalTrials.gov. Updated March 6, 2025. Accessed December 4, 2025.