肺癌,作为全球范围内发病率与死亡率最高的恶性肿瘤之一,其中超过85%的病例属于非小细胞肺癌(NSCLC)。尽管医学科技不断进步,非小细胞肺癌患者的五年生存率仍不尽如人意,从过去的15%提升至25%,这凸显了对更有效、更精准治疗策略的迫切需求。
近年来,以PD-1和PD-L1抑制剂为代表的免疫检查点抑制剂(ICI),通过阻断PD-1/PD-L1信号通路,显著增强了T细胞介导的肿瘤杀伤作用,彻底改变了非小细胞肺癌的治疗格局。然而,免疫治疗并非对所有患者都有效。在未经筛选的非小细胞肺癌患者中,免疫检查点抑制剂的客观缓解率(ORR)仅为10%-30%,部分患者甚至可能出现疾病加速进展或早期死亡。即使是PD-L1阳性患者,其客观缓解率也仅为30%-45%,而PD-L1阴性患者的缓解率更低,仅为15%-25%。这表明,现有生物标志物(如PD-L1表达水平、肿瘤突变负荷)在预测免疫治疗响应方面仍存在局限性,亟需更精准的预测工具。
创新突破:circRNA模型精准预测免疫治疗响应
在这一背景下,环状RNA(circRNA)作为一种新型的生物标志物,因其在癌症RNA表达失调中的作用,被认为有望成为预测免疫检查点抑制剂(ICI)治疗响应的关键指标。2025年11月25日,来自遵义医科大学第二附属医院的马虎教授和周建国副主任医师作为共同通讯作者,在国际知名期刊Therapeutic Advances in Medical Oncology上发表了一项题为“CircRNA signature predicts immunotherapy response in advanced non-small cell lung cancer”的重磅研究论文。
这项开创性研究系统性分析了两项大型非小细胞肺癌(NSCLC)临床研究中的circRNA表达谱,成功识别出与免疫治疗响应相关的差异表达circRNA。研究团队进一步构建了一个由11个circRNA组成的独特特征谱——circRNA-Sig。该模型旨在精准预测晚期非小细胞肺癌患者对免疫治疗的响应,为临床医生提供更具指导意义的治疗决策依据。

研究方法与关键发现:双重临床验证,揭示潜在机制
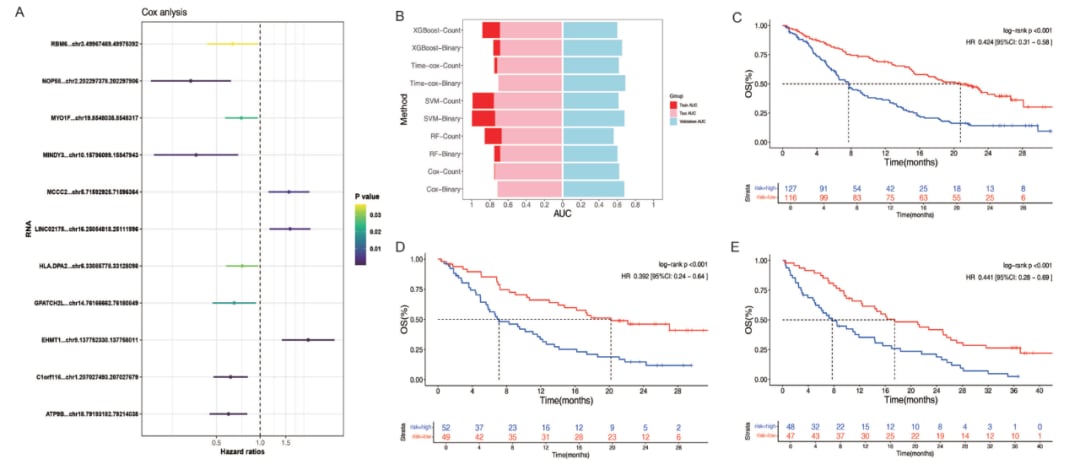
为了验证circRNA-Sig模型的预测效力,研究团队深入分析了来自OAK和POPLAR这两项大型临床试验中891名晚期非小细胞肺癌患者的circRNA表达数据。他们利用癌症circRNA免疫组数据库(The Cancer CircRNA Immunome Atlas database)筛选出在免疫治疗患者中显著差异表达的circRNA,并结合机器学习技术构建并验证了预测模型。
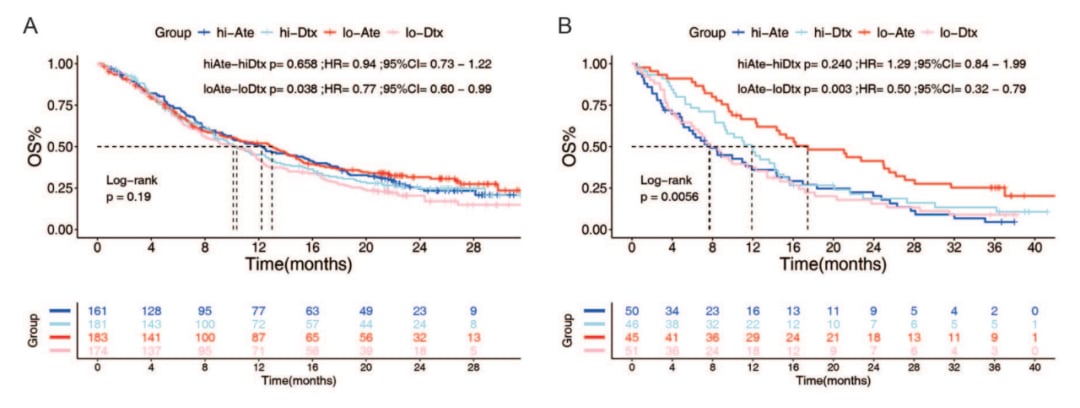
研究结果令人鼓舞:circRNA-Sig模型在OAK临床试验中预测阿替利珠单抗(Atezolizumab)疗效的曲线下面积(AUC)达到了0.71,在POPLAR临床试验中也达到了0.67。这表明该模型具有良好的预测准确性。更重要的是,生存分析结果显示,在OAK临床试验中,circRNA-Sig得分较低的患者从免疫检查点抑制剂治疗中获得的益处显著高于化疗(HR=1.347),而得分较高的患者则无显著差异。这为临床实践中筛选出最可能从免疫治疗中获益的患者提供了有力依据。
进一步的富集分析揭示了circRNA-Sig模型背后的潜在机制。得分低的患者表现出激活的肿瘤免疫微环境,其中干扰素-γ和IL-2/STAT5通路显著上调,能够有效激活CD8+ T细胞和自然杀伤(NK)细胞等关键免疫细胞。这一发现从机制层面解释了这些circRNA与免疫检查点抑制剂治疗敏感性之间的关联,为未来的药物研发和靶点探索提供了新思路。
基于 circRNA 标志物的模型构建与验证
基于 circRNA-Sig 的模型可作为预测生物标志物发挥作用
个性化治疗新纪元:提升肺癌患者生存希望
这项经两大临床试验队列严格验证的circRNA-Sig模型,为非小细胞肺癌(NSCLC)患者接受阿替利珠单抗(Atezolizumab)治疗提供了全新的、具有临床应用价值的分层工具。它不仅能够帮助医生更精准地选择适合免疫治疗的患者,避免无效治疗带来的副作用和经济负担,更有望推动肺癌个性化治疗策略的进一步发展,从而显著提升患者的治疗响应率和整体生存质量。
对于正在寻求阿替利珠单抗或其他创新抗癌药物的患者及家属,了解最新的临床研究进展至关重要。MedFind致力于为全球癌症患者提供便捷、可靠的药品代购与直邮服务,确保您能及时获取所需的救命药物。我们深知每位患者的用药需求都独一无二,因此,我们提供专业的AI问诊服务,帮助您更好地理解病情和治疗方案,并提供全球范围内的药物信息和诊疗指南,助您做出明智的决策。
如果您对非小细胞肺癌的治疗药物,如阿替利珠单抗的购买渠道、价格或相关信息有疑问,欢迎访问MedFind官网或咨询我们的专业团队。我们致力于成为您抗癌路上的坚实后盾,让前沿的医疗成果惠及更多患者。