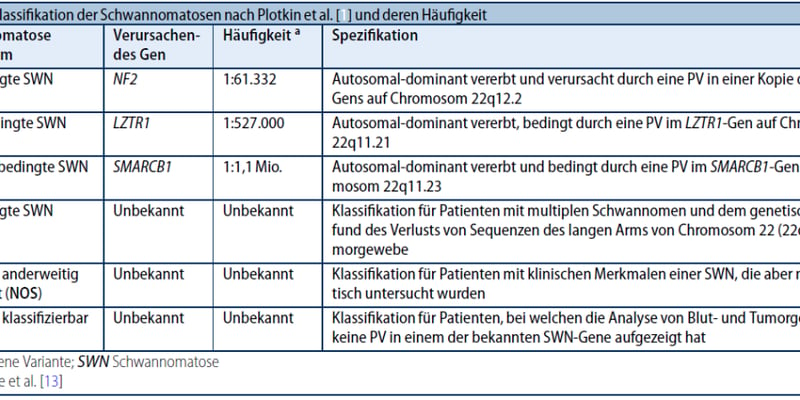
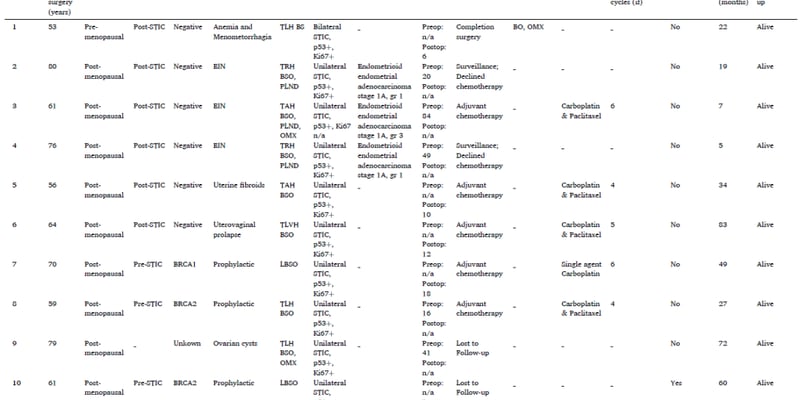
肺纤维化,一种进展隐匿且后果严重的慢性肺部疾病,在全球范围内发病率逐年攀升,尤其在中老年人群中更为常见。患者在确诊时,肺部往往已出现不可逆的瘢痕化和功能损伤。目前,针对肺纤维化的治疗手段仍十分有限,多以延缓病情恶化为主,难以从根本上治愈。因此,科学家们迫切希望能够识别疾病的早期触发因素,以便在损伤发生前进行有效干预。
颠覆认知:肺纤维化不仅仅是生物学问题
近日,国际权威期刊Nature Materials发表了一项由宾夕法尼亚大学等机构科学家们完成的开创性研究,题为“Local photocrosslinking of native tissue matrix regulates lung epithelial cell mechanosensing and function”。这项研究的独特之处在于,它将肺纤维化重新定义为一个机械问题,而不仅仅是传统的生物学问题。研究团队深入探索了肺部组织微环境的机械变化,如何悄然引发纤维化进程,尤其聚焦于疾病早期,即组织尚未严重瘢痕化和硬化之前,细胞行为如何受到组织硬度变化的影响。
蓝光技术揭示细胞“身份危机”
研究人员巧妙运用了一种特殊的光化学交联技术,通过温和的蓝光局部触发肺部组织周围的细胞外基质(一种为细胞提供支撑的纤维状支架)发生硬化。与可能损伤活细胞的紫外线不同,蓝光对活体组织更为友好,使其成为研究活体组织机械变化的理想工具。通过在健康小鼠和人类肺部组织中局部模拟组织硬化,研究人员得以近距离观察细胞的反应。

实验结果令人震惊:当组织在蓝光作用下硬化时,肺部细胞开始拉伸并改变形状。这种物理上的拉伸并非简单的形变,而是预示着细胞正在向另一种类型转变。然而,这些细胞并未能顺利完成转变,反而陷入了一种“身份危机”——它们既无法有效履行原有功能,也未能完全转变为新的细胞类型。这种独特的“过渡态”细胞此前已在纤维化组织样本中被发现,但其形成机制一直是个谜。这项研究首次揭示了组织硬度改变足以促使细胞进入这种“卡壳”状态。
恶性循环:组织硬度与疾病进展
研究进一步发现,当细胞陷入这种过渡态时,它们会反过来加剧触发组织硬度的变化,从而形成一个可能加速疾病发展的恶性反馈循环。这种细胞的“卡壳”状态不仅导致其原有功能的丧失,还会改变其形状,进而吸引那些在坚硬环境中能够“茁壮成长”的“坏细胞”,进一步加剧肺部损伤。
为了精确测量组织的硬度变化,研究人员甚至动用了通常用于测试塑料或金属等工程材料的纳米压痕仪。他们还发现,细胞外基质的局部交联和新蛋白质的沉积在早期组织纤维化中扮演着关键角色。通过抑制细胞骨架张力、机械敏感信号通路或整合素的参与,可以有效减少上皮细胞的扩散和分化。这些发现不仅强调了局部细胞外基联和新蛋白质沉积在早期组织纤维化中的重要作用,也为体外疾病建模和未来其他组织疾病的研究提供了新的思路。
展望未来:早期干预与治疗新希望
这项研究的突破性意义在于,它为肺纤维化的早期诊断和干预提供了全新的视角。理解机械力在疾病发生发展中的核心作用,有望为开发针对性的治疗策略开辟道路,从而在不可逆损伤发生之前阻止或逆转疾病进程。深入理解疾病机制,是寻找有效治疗方案的第一步。对于肺纤维化这类复杂疾病,患者和家属往往需要获取权威、全面的信息。例如,MedFind的AI问诊服务可以帮助患者更好地理解病情和治疗方案,从而做出更明智的决策。
随着研究的深入,未来可能出现针对这些新机制的靶向药物。届时,患者可以通过专业平台,如MedFind提供的海外靶向药代购服务,获取全球范围内的创新疗法。持续关注最新的医学进展,并获取可靠的药物信息和诊疗指南,对于所有重症患者都至关重要。
参考文献:
Ahmed, D.W., Tan, M.L., Liu, Y. et al. Local photocrosslinking of native tissue matrix regulates lung epithelial cell mechanosensing and function. Nat. Mater. (2025). doi:10.1038/s41563-025-02329-0