引言:结直肠癌免疫治疗面临的挑战
结直肠癌(CRC)是全球范围内高发的恶性肿瘤之一。尽管以抗PD-1为代表的免疫检查点抑制剂(ICIs)为许多癌症患者带来了曙光,但对于约95%的错配修复功能正常(pMMR)型结直肠癌患者而言,疗效却不尽人意。这类肿瘤由于其突变负荷低,肿瘤微环境呈免疫抑制状态,即所谓的“冷肿瘤”,导致其对免疫治疗天然耐药。因此,如何将“冷肿瘤”转化为对免疫治疗敏感的“热肿瘤”,是当前结直肠癌研究领域亟待解决的难题。
近期,中山大学的一项重大研究为攻克这一难题提供了新思路。研究团队发现,通过靶向一种名为SIRT2的酶,可以有效重塑肿瘤免疫微环境,并显著增强抗PD-1疗法的效果。这项发表于《Science Translational Medicine》的研究,为广大pMMR结直肠癌患者带来了新的希望。

SIRT2:调控结直肠癌免疫的关键“开关”
研究人员首先通过对结直肠癌患者样本的分析发现,SIRT2的表达水平与肿瘤的免疫状态密切相关。在pMMR型结直肠癌中,SIRT2低表达的肿瘤往往伴随着更强的免疫细胞(如CD8⁺ T细胞)浸润和更好的预后。这表明,SIRT2可能扮演着抑制抗肿瘤免疫的关键角色,是一个极具潜力的治疗靶点。
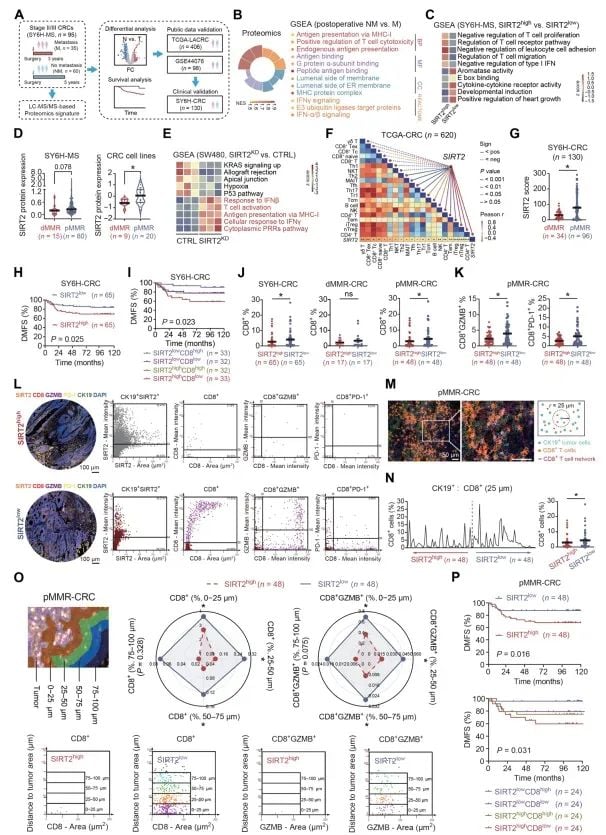
图1 低SIRT2表达与免疫活跃型结直肠癌相关
AGK2:唤醒免疫系统的“钥匙”
基于以上发现,研究团队探索了抑制SIRT2功能的治疗潜力。他们使用了一种名为AGK2的小分子抑制剂。研究揭示了其作用机制:
- 破坏MLH1蛋白稳定性: SIRT2通过去乙酰化作用来稳定DNA错配修复蛋白MLH1。当使用AGK2抑制SIRT2后,MLH1蛋白被降解,导致肿瘤细胞DNA损伤修复能力下降。
- 激活cGAS-STING通路: DNA损伤的累积会激活细胞内的cGAS-STING信号通路,这是一条关键的天然免疫通路。该通路的激活会促进多种免疫因子的释放,如干扰素(IFN)和趋化因子(CCL5)。
- 招募免疫细胞: 这些免疫因子如同“信号弹”,能够大量招募具有杀伤能力的CD8⁺ T细胞进入肿瘤内部,从而将“冷”肿瘤转变为免疫细胞浸润的“热”肿瘤。
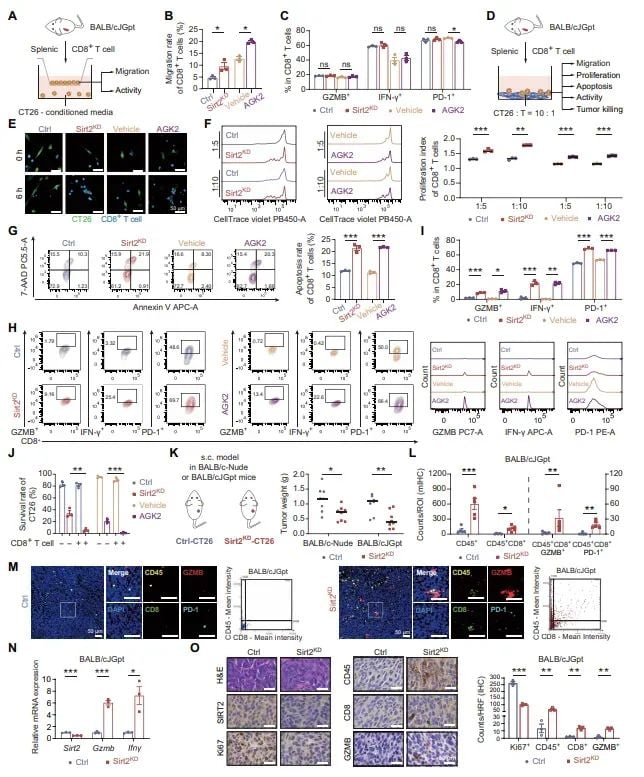
图2 抑制SIRT2增强CD8⁺ T细胞功能与肿瘤控制
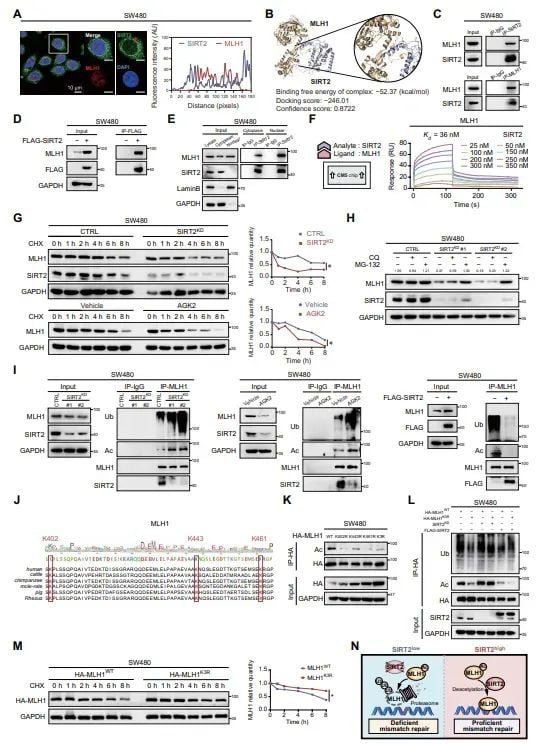
图3 SIRT2通过去乙酰化稳定MLH1蛋白
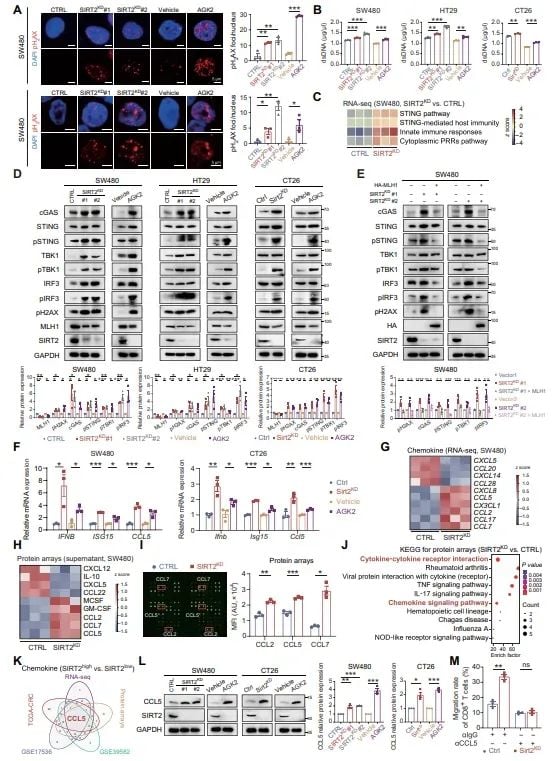
图4 SIRT2抑制诱导DNA损伤并激活cGAS-STING通路
AGK2联合抗PD-1:实现1+1>2的抗癌效果
研究最重要的发现是,AGK2与抗PD-1疗法的联合使用显示出强大的协同抗肿瘤效应。在pMMR结直肠癌的动物模型和患者来源的类器官模型中,单用抗PD-1药物效果有限,但当与AGK2联合使用时,观察到了显著的肿瘤消退和生存期延长。
AGK2预处理不仅增加了肿瘤内免疫细胞的数量,还通过诱导DNA损伤产生了更多的新抗原,使肿瘤更容易被免疫系统识别和攻击。这为后续的抗PD-1治疗清除了障碍,使其能够更有效地发挥作用,甚至建立了长期的抗肿瘤免疫记忆。
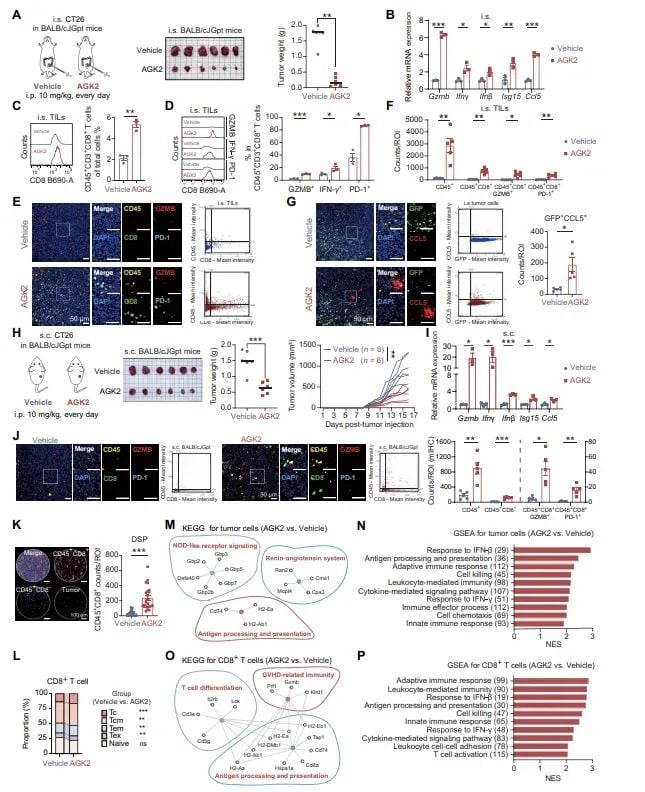
图5 AGK2重塑肿瘤免疫微环境并增强CD8⁺ T细胞浸润

图6 AGK2诱导新抗原产生并建立长期免疫记忆
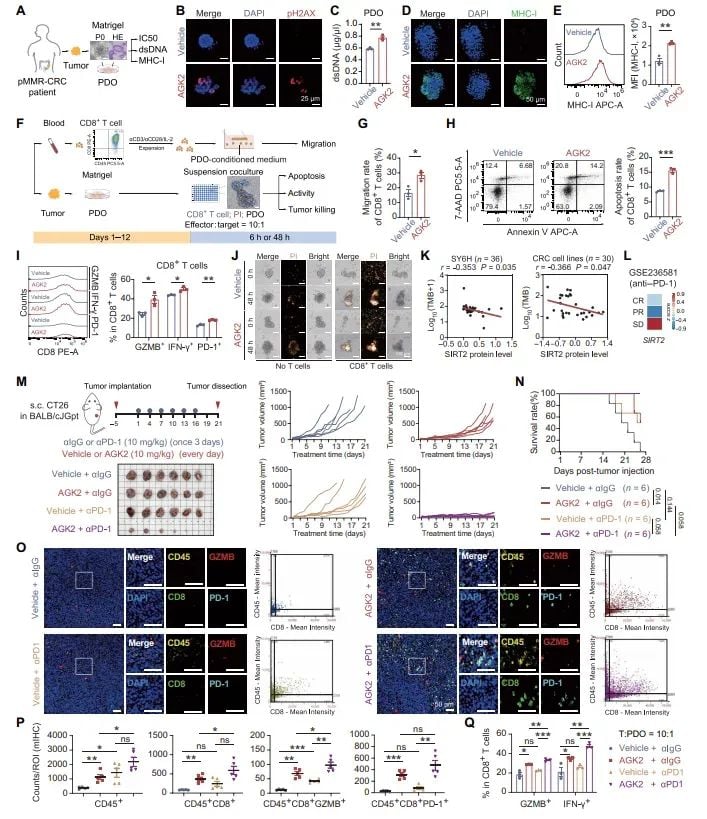
图7 AGK2联合抗PD-1协同增强pMMR-CRC免疫疗效
研究总结与展望
总而言之,这项研究系统地阐明了SIRT2在pMMR结直肠癌免疫逃逸中的关键作用,并证实了靶向SIRT2的抑制剂AGK2是一种极具潜力的治疗药物。通过将“冷”肿瘤转化为“热”肿瘤,AGK2为克服pMMR结直肠癌的免疫治疗耐药性提供了一个全新的、有效的策略。虽然AGK2目前仍处于临床前研究阶段,但其展现出的巨大潜力预示着未来结直肠癌治疗,特别是免疫联合治疗,将迎来新的突破。对于正在寻求更有效治疗方案的结直肠癌患者来说,这无疑是一个振奋人心的消息。





