对于全球数百万癌症患者而言,每一次新药的突破都意味着新的希望。近日,欧洲药品管理局(EMA)人用药品委员会(CHMP)发布了一项积极意见,推荐批准UM171细胞疗法(商品名:Zemcelpro)用于治疗需要异基因造血干细胞移植,且缺乏合适供者细胞的成人血液系统恶性肿瘤患者。这一里程碑式的进展,无疑为饱受急性淋巴细胞白血病(ALL)、急性髓系白血病(AML)、骨髓增生异常综合征(MDS)等疾病困扰的患者带来了新的曙光。
Zemcelpro(UM171细胞疗法)的独特之处
Zemcelpro(UM171细胞疗法)是一种创新的冷冻保存造血干细胞移植产品,由UM171扩增的CD34阳性细胞(dorocubicel)和未扩增的CD34阴性细胞组成,两者均来源于同一份脐带血。如果获得欧盟委员会的最终批准,Zemcelpro将成为欧盟首个且唯一获批用于此类患者群体的疗法,填补了长期存在的未满足医疗需求。
关键临床研究数据:疗效与安全性
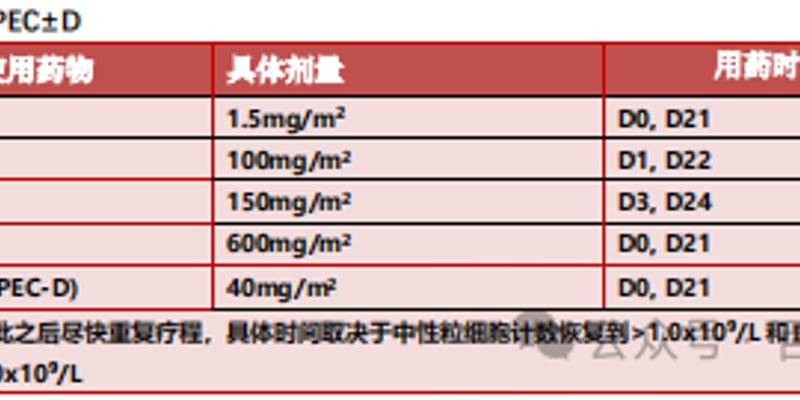
UM171细胞疗法的积极意见,主要基于两项独立的前瞻性II期临床试验(NCT02668315)数据。这些研究旨在评估该疗法在高危血液系统恶性肿瘤患者中的疗效和安全性。研究纳入了52名患者,在平均24个月的随访期内,展现出令人鼓舞的结果:
- 总生存期(OS)与无进展生存期(PFS): 两年总生存率为67%(95% CI, 54%-82%),两年无进展生存率为63%(95% CI, 50%-79%)。
- 高危患者的获益: 对于接受第二次或第三次移植的患者,以及携带TP53突变的患者,两年总生存率分别为64%和40%,两年无进展生存率均为40%。这表明UM171细胞疗法在高危患者群体中也具有显著潜力。
- 非复发死亡率与复发率: 两年非复发死亡累积发生率为19%,复发率为18%。
- 移植物抗宿主病(GVHD)管理: 2至4级急性GVHD发生率为69%,其中3/4级急性GVHD发生率为16%。中度至重度慢性GVHD发生率为7%,慢性无复发生存率为55%。这些数据表明,在标准GVHD预防方案(他克莫司和吗替麦考酚酯)下,UM171细胞疗法的安全性可控。
未来展望与患者获取途径
ExCellThera公司首席执行官David Millette表示,此次积极意见使UM171细胞疗法更接近为欧盟地区面临风险的血液系统恶性肿瘤患者带来改变生命的潜力。欧盟委员会预计将在未来两个月内公布最终决定,该决定将适用于所有27个欧盟成员国以及冰岛、挪威和列支敦士登。此外,该疗法还计划向美国、加拿大、英国和瑞士等其他监管机构提交申请,有望在全球范围内惠及更多患者。
对于国内患者而言,面对这类创新且尚未在国内上市的疗法,海外购药或通过靶向药代购服务成为获取最新癌症治疗药物的重要途径。了解药物的获取途径、价格以及相关药物信息和诊疗指南,对于患者及其家属至关重要。随着全球医药创新的加速,及时获取前沿的细胞疗法和靶向药信息,将有助于患者做出更明智的治疗选择。