在全球范围内,胃癌是第五大常见癌症,也是导致癌症死亡的第四大原因,其早期诊断和治疗策略仍面临诸多挑战。近年来,除了已知的幽门螺杆菌,越来越多的研究开始关注其他肿瘤内微生物群对胃癌发生发展的影响。深入理解这些微生物群如何支持胃癌的恶性进展,对于改进现有治疗方法至关重要。
具核梭杆菌:胃癌进展与不良预后的新关联
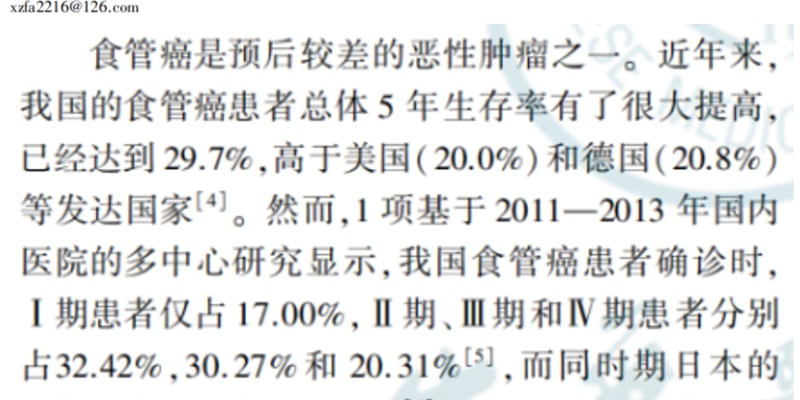
2025年5月15日,中山大学蔡世荣、陈剑辉与广东省微生物安全与健康重点实验室吴清平团队在《Cancer Research》杂志上联合发表了一项重要研究,题为“Intratumoral Fusobacterium nucleatum Recruits Tumor-Associated Neutrophils to Promote Gastric Cancer Progression and Immune Evasion”。该研究深入探讨了胃癌恶性进展过程中,瘤内微生物群对肿瘤免疫微环境(TIME)的具体影响。
通过对人胃癌组织进行16S rRNA扩增子测序分析,研究团队发现了一种新型的非幽门螺杆菌病原体——具核梭杆菌(Fusobacterium nucleatum)。这种革兰氏阴性、不产芽孢的机会性共生厌氧菌,在伴有淋巴结转移的胃癌组织中显著富集,并且与患者的不良预后密切相关。在小鼠模型中,具核梭杆菌感染不仅能自发诱导慢性胃炎,还能进一步促进胃黏膜异型增生。更令人关注的是,与免疫缺陷小鼠相比,在免疫健全小鼠中,具核梭杆菌感染显著加速了胃癌细胞的生长,这提示其在宿主免疫系统存在的情况下,对肿瘤进展具有更强的促进作用。

机制揭示:重塑免疫微环境,促进免疫逃逸
为了揭示具核梭杆菌影响胃癌进展的深层机制,研究人员利用单细胞RNA测序技术,发现具核梭杆菌通过招募肿瘤相关中性粒细胞(TAN)来重塑肿瘤免疫微环境。具体机制在于,具核梭杆菌能够侵入胃癌细胞,并激活IL17/NF-κB/RelB信号通路,从而诱导肿瘤相关中性粒细胞的大量募集。不仅如此,具核梭杆菌还会刺激这些肿瘤相关中性粒细胞分化为促肿瘤亚型,并继发性地促进PD-L1的表达。PD-L1的高表达是肿瘤细胞逃避免疫系统攻击的关键机制之一,它能导致CD8+ T细胞的耗竭,从而促进胃癌的免疫逃逸。
这项研究还发现,具核梭杆菌的存在不仅促进了胃癌的免疫逃逸,还意外地增强了抗PD-L1抗体免疫治疗的效果。这为理解肿瘤内微生物群与免疫治疗反应之间的复杂关系提供了新的视角。

模式机理图(图片源自Cancer Research)
治疗启示:靶向策略与抗癌药新方向
这项研究的发现,为开发更有效的胃癌治疗策略提供了重要见解。通过揭示具核梭杆菌影响胃癌免疫逃逸和免疫治疗疗效的机制,未来有望开发出针对具核梭杆菌或其相关信号通路的靶向药,从而抑制胃癌的进展并增强免疫治疗的敏感性。这对于寻求创新抗癌药和治疗方案的患者来说,无疑是令人鼓舞的消息。
对于寻求前沿治疗方案的患者,了解海外靶向药的获取途径至关重要。MedFind作为专业的海外靶向药代购平台,致力于为癌症患者提供便捷的购药服务,确保患者能够及时获得所需的抗癌药。此外,MedFind还提供AI问诊服务,帮助患者更好地理解病情和治疗选择,并提供丰富的药物信息与诊疗指南,助力患者抗癌之路。
本研究明确了具核梭杆菌在胃癌免疫逃逸中的关键作用,并揭示了其如何调节对免疫治疗的反应。这些发现不仅加深了我们对胃癌病理生理学的理解,也为未来开发新型靶向药和优化现有免疫治疗方案指明了方向,有望为全球胃癌患者带来新的希望。