肺浸润性黏液腺癌概述
侵袭性黏液腺癌(IMA)是肺腺癌中一种独特的组织学亚型,其临床表现、影像学特征、组织病理学和分子生物学特点均有别于其他类型。相较于侵袭性非黏液性腺癌(INMAs),IMA较为罕见,约占肺腺癌病例的3%至10%。在影像学检查中,IMA可能呈现为实性结节或肺样实变区域,且多灶性、双侧肺受累的情况并不少见,这使得其容易与肺炎或转移性肿瘤混淆,给临床诊断带来挑战。本综述旨在深入剖析IMA的组织病理学特征,并阐述其遗传学进展,为肺癌患者的精准诊断和治疗提供参考。
浸润性黏液腺癌的组织学分型
根据世界卫生组织(WHO)的最新分类,IMA主要分为杯状细胞型(类似于胃小凹上皮)和柱状细胞型(类似于反应性呼吸道上皮细胞)。然而,在实际诊断中,IMA还可能存在多种其他形态学变异,这些变异在小活检样本中尤其难以准确识别。
1. 腺泡型:这是IMA中最常见的形态。肿瘤细胞通常位于基底,细胞核温和,可见明显的胞质顶端黏液空泡,并伴有数量不等的杯状细胞,瘤细胞常呈簇状分布。
2. 柱状细胞型:WHO分类中公认的形态。部分病例的瘤细胞缺乏黏液空泡,可能被误诊为非黏液腺癌。这类瘤细胞核呈长杆状,基底极性存在,核异型性轻微。尽管胞质顶端黏液空泡多缺失,但细胞外黏蛋白的存在是黏液腺癌的显著特征。黏蛋白染色(如DPAS)有助于突显细胞内黏蛋白成分。
3. 印戒细胞型:以单一胞质空泡显著,细胞核偏心。与杯状细胞的关键区别在于瘤细胞核缺乏基底极性。目前专家认为,印戒细胞型是非黏液腺癌的一种变异亚型,不归类为IMA的特异亚型。
4. 透明细胞型:在IMA中极为罕见,细胞质透明,可能伴有或不伴有核周空泡,类似于非黏液腺癌的透明细胞或其他器官系统中的透明细胞肿瘤。镜下可见细胞核基底极性及胞质顶端黏液空泡的缺失,这与非黏液腺癌的透明细胞特征一致。因此,小活检中仅见透明细胞不足以诊断IMA。
5. 胎儿型:肿瘤细胞呈柱状形态,可见明显的胞质空泡,类似于具有肠母细胞分化的胃腺癌或肺胎儿腺癌。研究表明,这种形态常与其他高级别组织学特征相关,但其预后意义尚待进一步研究。
6. 肠型:少数IMA病例可表现出肠腺癌特征,肿瘤细胞胞质丰富,具有长杆核和假复层核,类似于发育不良的肠上皮,未见中央凹分化或杯状细胞。肿瘤基质类似于肠道黏膜,包含丰富的免疫细胞群。尽管肺和肠道免疫组化标记物在IMA中可共同表达,但细胞外黏蛋白沉积在肠腺癌中不明显。
7. 壁结节样病变:一小部分IMA患者出现类似于肺外黏液腺癌的壁结节样病变,表现为肉瘤样或巨细胞形态。由于病例数量较少,其对生存特征的真实影响尚不明确,但这种组织学特征可能反映了IMA的去分化。
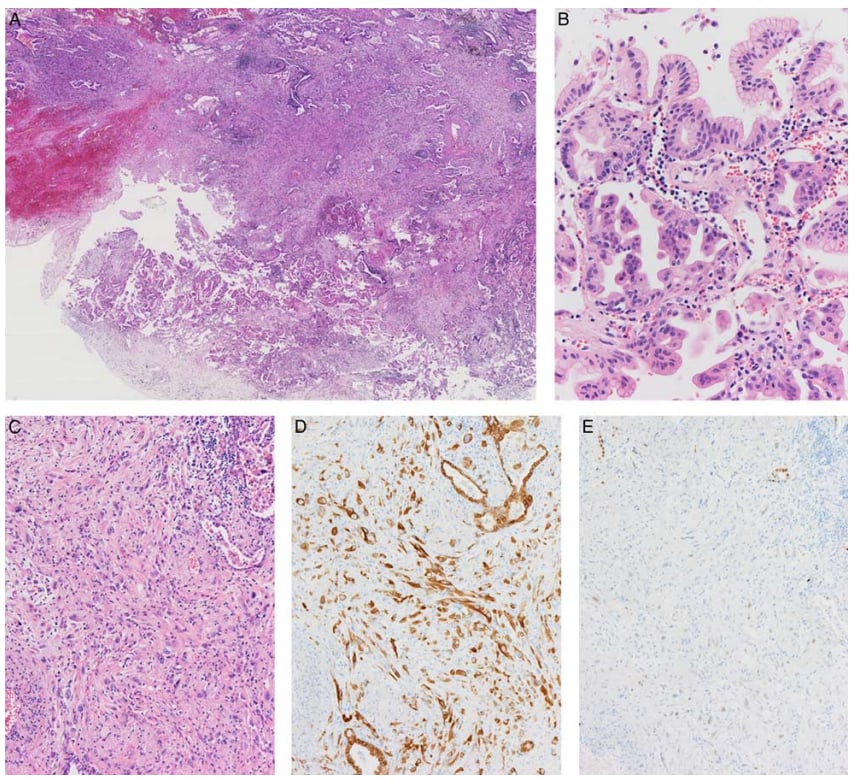
图1. IMA中肉瘤样壁结节样病变。离散结节样区域(A)被IMA包围,后者在组织学上显示典型的杯状和高柱状细胞(B)。壁状结节样病变由梭形细胞和多形细胞(C)组成,AE1/AE3染色阳性(D),突出显示了这种病变的上皮性质。IMA的关键分子HNF4α的表达明显降低(E)。图片源自Am J Surg Pathol 2022;46:1524–1532。
8. 胶样腺癌:2021年WHO分类中与IMA不同的一种亚型,但两者可能在同一肿瘤中并存。胶样腺癌的特点是产生大量细胞外黏蛋白,可见显著的胶样切面,导致肺泡壁破坏和肿瘤细胞从间质脱离,形成假囊性外观。向具有经典IMA形态的区域过渡是诊断胶样腺癌的重要线索,特别是当肿瘤细胞在黏液基质中稀疏分散时。胶样成分占比超过50%是诊断胶样腺癌的重要依据。
9. 混合型黏液和非黏液腺癌(MMNA):目前归类为IMA,定义为黏液和非黏液成分的混合,每种成分占肿瘤总体积的10%或以上。除了显示非经典形态学和高级特征的病例,大多数病例的组织学区别显著。浸润性黏液腺癌的关键特征是细胞外黏蛋白沉积,无论形态如何,这与非黏液腺癌不同。当肿瘤其他区域可见经典IMA形态学时,肿瘤的组织学异质性也是重要的诊断依据。在小活检和大切标本之间存在组织学差异的情况下,需要广泛取材。在小活检中不推荐进行分类,也没有必要,因为它与目前的治疗方案不相关。从预后角度看,显著(≥10%)的非黏液腺癌成分与更差的预后相关。MMNA的预后介于有和没有高级别特征的IMA之间。
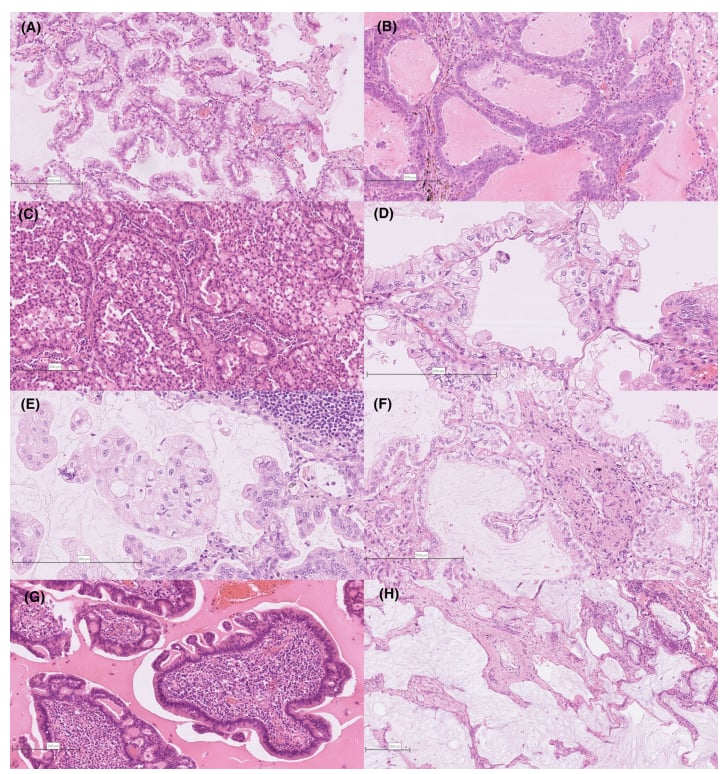
图2。浸润性黏液腺癌的经典和变异亚型。(A)杯状细胞型。(B)柱状细胞型。黏蛋白空泡丢失,细胞外黏蛋白沉积。(C)印戒细胞型。瘤细胞中含有明显的胞质空泡,挤压细胞核。(D、E)透明细胞型。瘤细胞含有透明的细胞质,核周空泡化。(F)胎儿型。瘤细胞类似于透明细胞;然而,关键的区别在于,瘤细胞存在独立的亚核空泡,挤压瘤细胞核远离基质。(G)肠型。瘤细胞类似于发育不良的肠上皮,具有结构和细胞异型性。免疫细胞的微环境也类似于肠道黏膜。(H)胶样腺癌。黏蛋白池破坏肺泡,邻近IMA可见杯状细胞样成分(右)。
关键分子遗传学特征与靶向治疗前景
IMA的基因组改变与INMAs存在显著差异。与INMAs相比,IMA中常见的致癌驱动突变包括KRAS(在白种人中多见)和EGFR(在亚洲人群中多见)。最新的高通量测序技术(如NGS和WES)研究显示,KRAS突变仍然是IMA中最常见的致癌驱动突变,约占所有病例的53.3%。
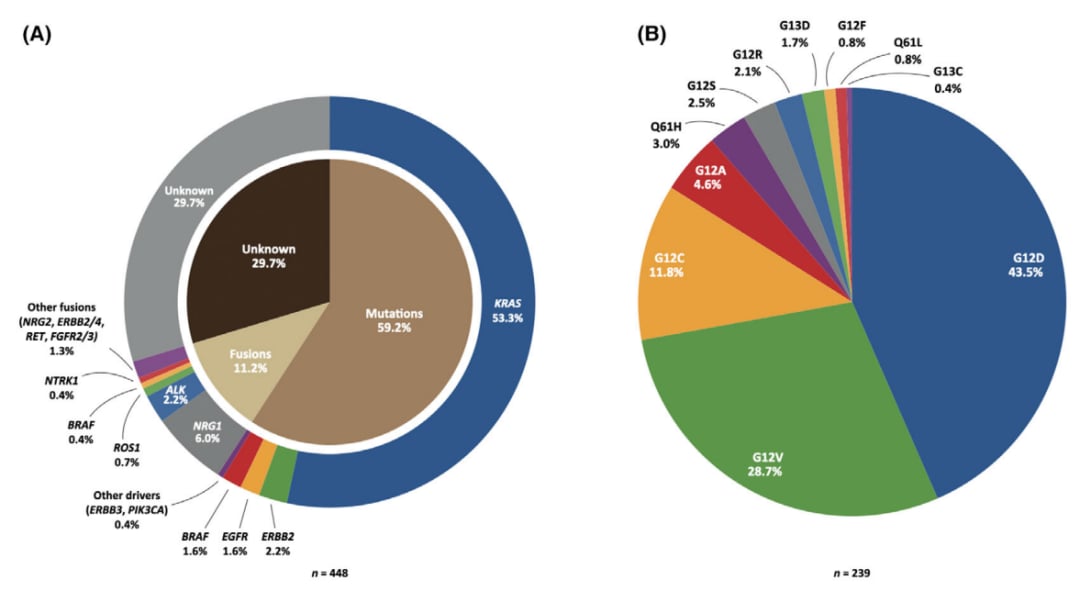
图3. 侵袭性粘液腺癌的基因组改变。
肿瘤细胞的克隆关系:IMA常表现为多灶性或多叶性病变,这提示可能存在原发肿瘤或肺内同步转移。区分两者至关重要,因为它直接影响肿瘤分期、治疗决策和预后。同步肿瘤单独分期,而肺内转移则根据是否涉及同一叶、同侧叶或对侧叶,分期为T3、T4或M1a。NGS技术研究发现,多个肿瘤病灶的IMA主要是肺内转移,同步肿瘤较少。研究还发现,初始肿瘤和后续肿瘤具有相同的KRAS突变,表明后续肿瘤是肺内扩散而非新的原发肿瘤。不同病灶的瘤细胞均具有相同的KRAS和NKX2-1位点突变,也提示肺内转移。
MMNA和胶样腺癌的驱动突变:NGS研究发现,MMNA中存在KRAS、BRAF、EGFR突变和ALK重排,其中KRAS突变占主导地位。约50%的胶样腺癌出现KRAS突变,常见突变位点包括G12D、G12V、G12R和G12C。其他常见突变包括STK11(75%)和PAPR1(50%)。
由先天性肺气道畸形引起的侵袭性黏液腺癌:先天性肺气道畸形(CPAM)是一种罕见的囊性病变,发病率为1/2500。在大约三分之一的病例中,CPAMs囊肿内衬的粘液细胞簇(MCCs)可发展成IMA或MMMA。大多数病例发生在1型CPAMs中,单纯囊内生长与惰性行为和良好预后相关;而囊外生长(伴或不伴囊内)的患者则与侵袭性生长模式、气腔扩散(STAS)、复发或转移有关。分子遗传学研究发现,CPAMs中发现的MCCs常存在KRAS突变(G12D、G12V和G12C),此外还可见FHIT、Rb和p16INK4的突变。
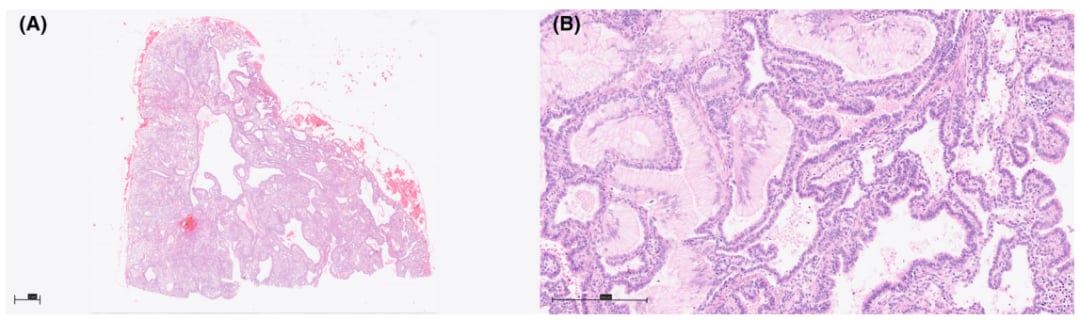
图4. 由1型CPAM引起的黏液腺癌。(A)囊肿内有纤毛呼吸型上皮,其间有肺实质;后者显示晚期囊状至肺泡期发育停滞。(B)囊性病变内多灶性受累,轻度不典型黏液细胞,呈杯状细胞形态,纯鳞状生长模式。这些病变跨越的距离至少为15mm。NGS结果显示KRAS c.35G>A (p。G12D)突变,变异等位基因频率为31.7%。
对于确诊患者,精准的靶向治疗方案至关重要。识别这些关键基因突变是选择合适靶向药的基础。如果您正在寻找海外靶向药或抗癌药,MedFind提供专业的海外靶向药代购服务,确保您能及时获取所需的仿制药或原研药。同时,我们的AI问诊服务也能为您提供初步的用药咨询和诊疗建议,助您更好地了解疾病与治疗选择。访问MedFind官网,了解更多抗癌资讯和购药详情。
鉴别诊断要点
1. 伴有细胞内黏蛋白产生的非黏液性腺癌:分散的胞浆内黏蛋白在非黏液性腺癌(NMA)中常见,但在缺乏IMA形态和细胞外黏蛋白的情况下,不足以诊断IMA。不建议使用组织学染色或IHC检测黏蛋白来筛查IMA。在小活检样本中,偶尔的病例可能难以分类,此时可采用“具有黏液和非黏液特征的腺癌”这一诊断术语。
2. 肺外源性转移性黏液腺癌:尽管IHC标记物通常有用,但由于免疫谱重叠,部分转移性黏液腺癌与肺原发癌难以鉴别。IMA在基因组、转录组学和甲基组学上与肺外部位的黏液腺癌相似,因此目前的分子平台在确定肿瘤起源位置方面的效用有限。临床病史、放射学改变以及对相关病变的组织学评估仍是目前鉴别诊断的最佳策略。
3. 细支气管腺瘤及其他产生黏蛋白的良性肺肿瘤:近端和远端型细支气管腺瘤(BA)均含有黏液上皮细胞,基底细胞层的保留是两种类型BA的基本特征,它的存在可以排除IMA。然而,两者在术中冷冻切片的诊断中具有挑战性。
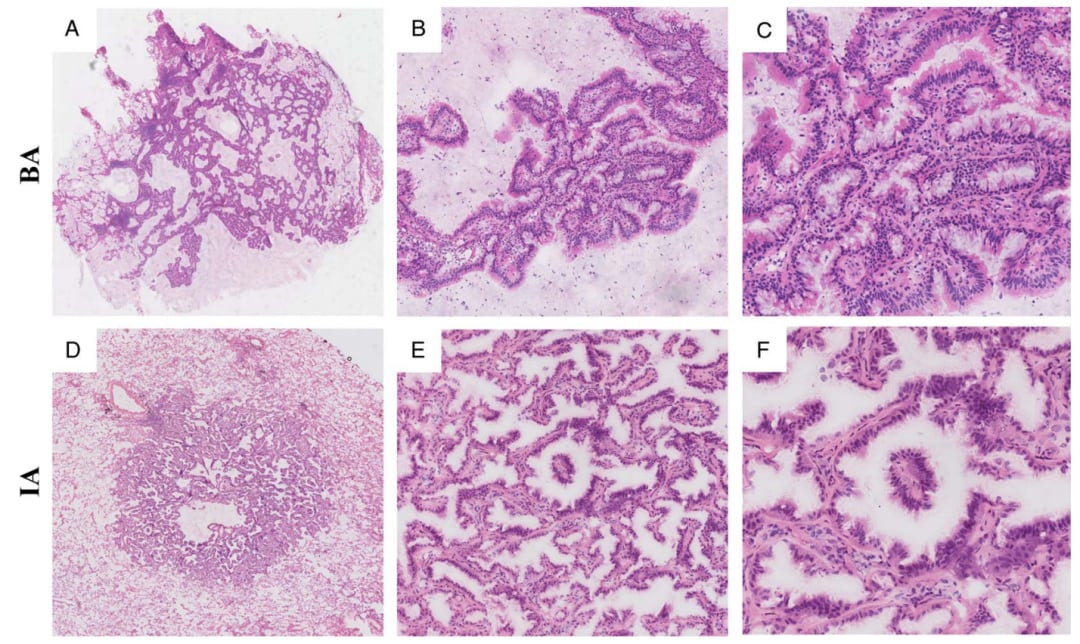
图5. 细支气管腺瘤(BA)和浸润性腺癌(IA)的乳头状结构。A和B,低中倍放大BA的乳头状结构。C,BA的乳头一般为圆形,轮廓光滑,表面有纤毛细胞、粘液细胞和底部连续的基底细胞。D和E,低、中放大倍数下IA的乳头状结构。F,IA的乳头纤细、坚硬、复杂,表面为非典型上皮细胞,底部无基底细胞。图片源自Am J Surg Pathol 2023;47:431–439
4. 慢性呼吸道疾病中的黏液性化生:不同程度的杯状细胞化生是慢性炎症和纤维化肺疾病的显著特征。在这些疾病中,评估支气管血管束和远端肺实质之间的关系存在困难。特别是对于终末期肺纤维化,蜂窝囊肿和细支气管周围化生伴黏液上皮化生都可类似于IMA的形态。此外,间质性肺炎(UIP)与IMA相关。在一些形态不典型的病例中,没有形态学或免疫组化标记物可以可靠地区分IMA和良性病变。基因组测序识别癌症相关突变的范围会受到小诊断样本中组织数量的影响。最近,空间蛋白质组学研究发现,UIP上皮中的MUC5B和MUC5AC与IMA的表达模式存在差异。然而,黏蛋白染色在这种情况下的诊断价值值得进一步研究。
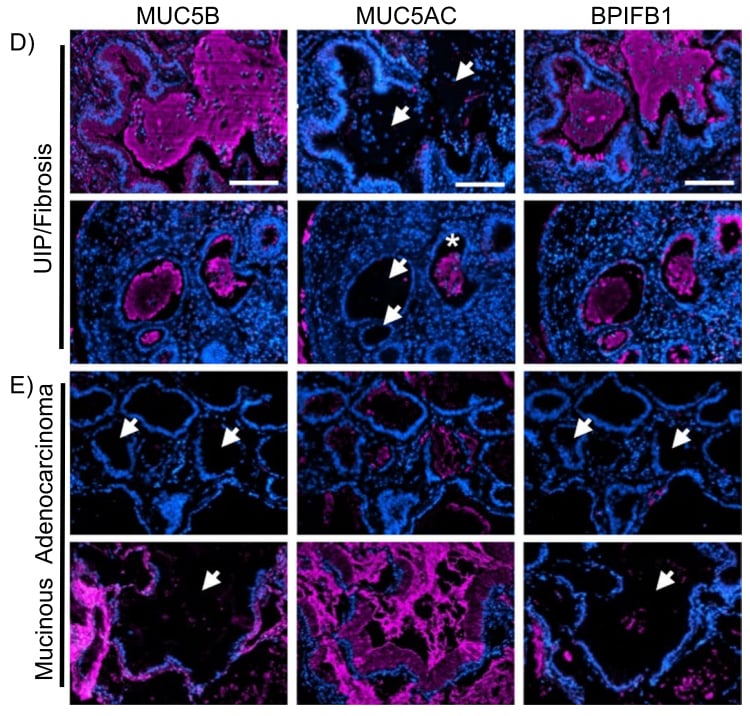
图6. UIP黏液和黏液腺癌黏液中MUC5B、MUC5AC和BPIFB1的免疫荧光,显示每种疾病类型的代表性图像。白色箭头表示黏液积累区域,星号表示UIP黏液中MUC5AC阳性。图片源自Herrera et al. Respiratory Research (2023) 24:99
总结与展望
尽管非黏液腺癌的分型和分级已成为WHO分类的一部分,但对IMA和其他黏液腺癌模式的评估相对滞后,这主要是由于其相对罕见导致相关证据缺乏。然而,越来越多的证据表明,分级系统具有潜在的预后价值,并且对生长模式和核特征的评估也日益精准。基因组学的进展也强调,这些肿瘤有肺内转移的倾向,未来的分期和治疗策略需要充分参考IMA疾病进展的不同模式。随着对IMA分子特征的深入理解,靶向治疗和抗癌药的研发将更加精准,为患者带来更多希望。





