神经母细胞瘤是一种起源于神经嵴细胞的儿童恶性实体肿瘤,多发于5岁以下婴幼儿。这种肿瘤具有高度的生物学异质性,不同亚型预后差异巨大。临床上根据风险程度分为低危、中危和高危。中低危患者通常预后较好,但高危神经母细胞瘤侵袭性强,即使接受现有治疗,五年生存率仍低于50%。肿瘤微环境的复杂性以及肿瘤细胞获得性耐药是导致预后差异和治疗失败的重要原因。
既往研究通过表观遗传学分析,已将神经母细胞瘤分子表型区分为肾上腺素样(ADRN)和间质样(MES)。ADRN型肿瘤细胞分化程度较高,对化疗相对敏感;而MES型则表现为低分化、易耐药和转移。随着单细胞转录组学等技术的发展,我们得以更精细地描绘肿瘤细胞内部的异质性,并解析肿瘤微环境中各类细胞间的复杂互动,这为理解肿瘤的侵袭、转移以及治疗如何重塑微环境提供了全新的视角。然而,神经母细胞瘤与免疫微环境的相互作用及其具体的耐药机制仍有待深入阐明。
近日,一项由费城儿童医院 Kai Tan 团队主导、发表于国际顶级期刊 Nature Genetics 的研究,利用单细胞多组学技术(包括snRNA-seq、snATAC-seq和WGS),深入剖析了化疗对高危神经母细胞瘤微环境的影响。研究重点关注了肿瘤相关巨噬细胞(TAM)对治疗的反应及其与肿瘤细胞的相互作用,并鉴定出HB-EGF(肝素结合性表皮生长因子样生长因子)是促进肿瘤增殖和耐药的关键分子。这项工作为探索神经母细胞瘤的耐药分子机制指明了新的方向。
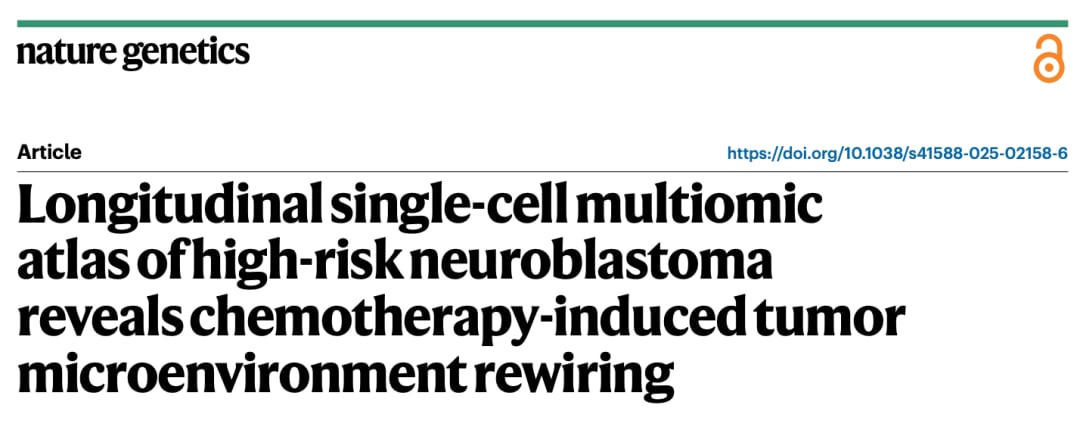
研究团队收集了22例高危神经母细胞瘤患者的样本,其中包括同一患者在诱导化疗前活检和化疗后手术切除的配对样本。通过snRNA-seq和snATAC-seq分析,研究人员获得了大量高质量的细胞数据,并注释出8种主要的细胞群,包括神经母细胞、成纤维细胞、施万细胞、内皮细胞、巨噬细胞、树突状细胞、T细胞和B细胞。初步分析发现,在化疗后的样本中,成纤维细胞和巨噬细胞的数量有所增加。
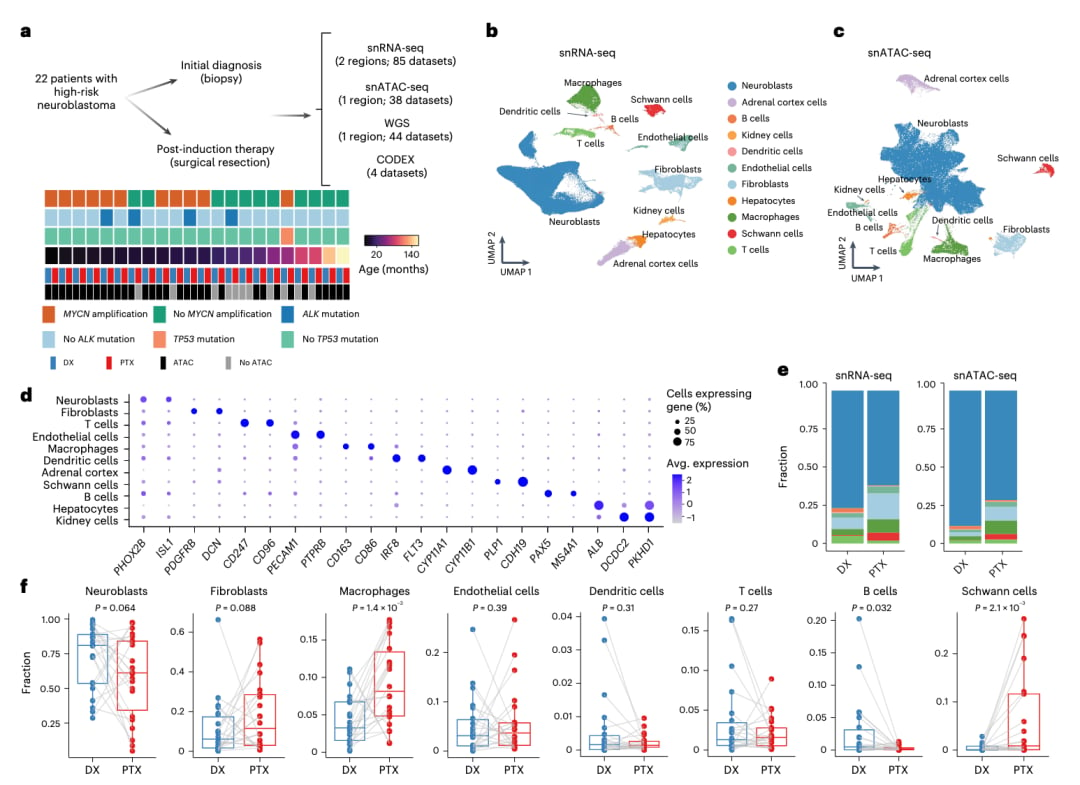
图1: snRNA-seq和snATAC-seq初步分析结果,按细胞类型注释得到UMAP图(c),各种细胞在治疗前后的分布比例(e),snRNA-seq数据中患者治疗前后的细胞类型比例变化(f)。
为了解析肿瘤细胞内在的异质性,研究人员结合WGS和snRNA-seq数据识别肿瘤细胞,并将其聚类划分为6种不同的状态,包括4个ADRN高表达簇、1个MES高表达簇以及1个兼具ADRN和MES特征的中间簇(Interm-OXPHOS)。ADRN高表达簇又可细分为ADRN-钙、ADRN-多巴胺能、ADRN-基线和ADRN-增殖等亚群。
随后,研究评估了这些新定义的肿瘤细胞群体在化疗前后的变化。结果显示,ADRN-基线和ADRN-增殖群体在治疗后减少,而ADRN-钙、ADRN-多巴胺能和Interm-OXPHOS群体则有所增加。值得注意的是,携带ALK突变的患者,其ADRN-基线和ADRN-增殖群体的减少幅度较小,且治疗后MES状态显著下降,这提示ALK突变可能影响高危患者对化疗的反应。研究还结合临床信息,评估了这些细胞状态与临床预后的相关性。
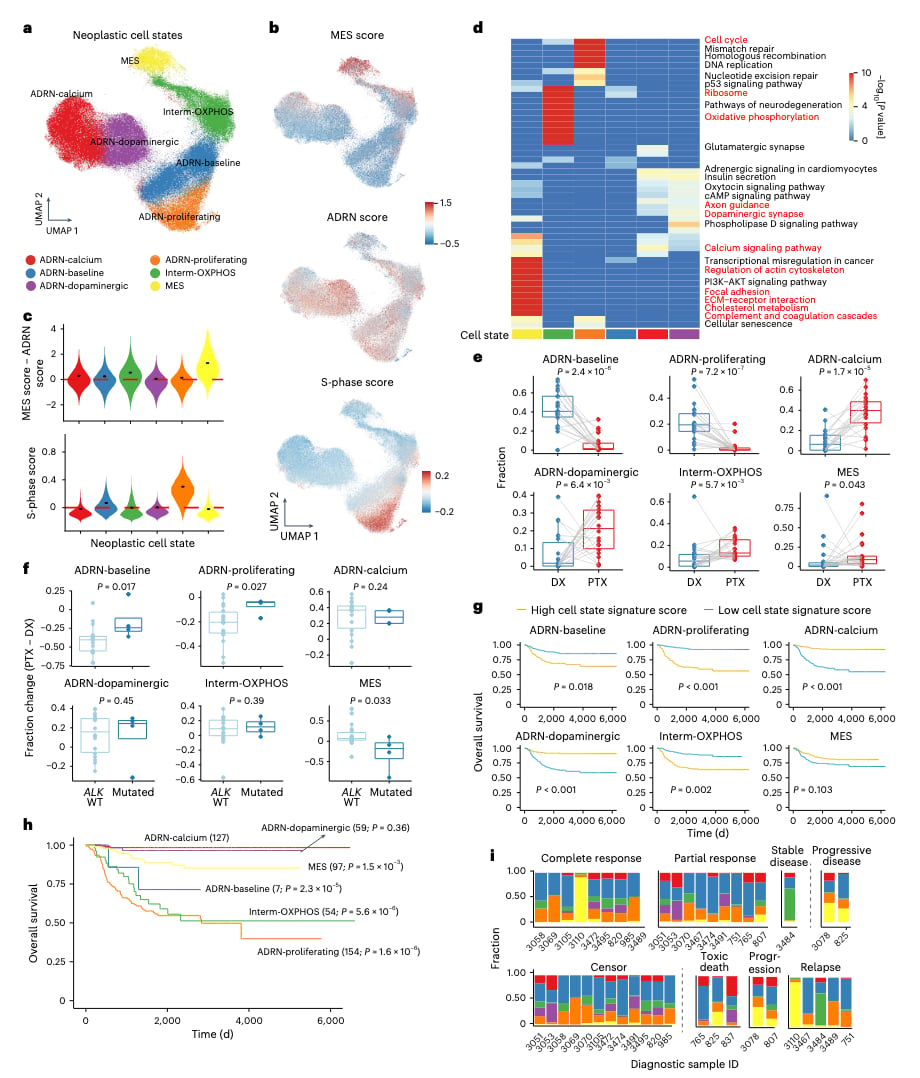
图2: 对肿瘤细胞进行注释分群,按不同的细胞状态对肿瘤细胞进行评估,KEGG&GO通路富集(d),治疗前后细胞比例变化(e),按ALK突变状态分层的治疗前后细胞比例变化(f),生存分析(g)(h),不同肿瘤细胞状态下对治疗的临床反应(i)。
在明确肿瘤细胞状态特征后,研究人员利用snATAC-seq数据进一步探索了这些状态的转录调控机制,构建了转录调控网络。结果发现,AP-1编码基因及其靶基因在化疗后上调,这与治疗后MES表型上调的观察一致。尽管ADRN-增殖这一预后不良的群体在治疗后数量减少,但表征其状态的基因特征仍得以维持,这可能部分解释了神经母细胞瘤难以根治和产生耐药性的原因。
为了深入分析高危神经母细胞瘤的耐药机制,研究人员重点分析了肿瘤微环境中数量最丰富的免疫细胞——肿瘤相关巨噬细胞(TAM)。通过整合聚类snRNA-seq数据中的TAM,研究人员识别出8个TAM亚群,并根据细胞状态将其归纳为7种不同类型(增殖、促炎、促血管生成、免疫抑制、组织驻留、脂质相关及未定义状态)。这些TAM细胞状态在化疗前后表现出显著变化。其中,仅IL-18+促炎状态的TAM群体在治疗后减少,提示这类巨噬细胞可能与更好的预后相关。
随后,研究利用CytoTalk工具预测了TAM与肿瘤细胞之间的配体-受体相互作用。结果显示,这些相互作用涉及多种促进细胞粘附、迁移和血管生成的分子,其中表皮生长因子家族(ErbB)受体(ERBB4和EGFR)与多种配体之间的相互作用最为普遍。为了在空间层面验证这些相互作用,研究使用了CODEX空间蛋白质组学技术对石蜡包埋样本进行检测,并鉴别出3种肾上腺素能神经母细胞亚群。研究发现,ERBB4受体在ADRN-like-2神经母细胞中高表达,而其配体HB-EGF和TGFA则在这些细胞周围高密度分布,且ADRN-like-2细胞在空间上更靠近巨噬细胞。这强有力地提示,巨噬细胞诱导的ErbB信号传导可能是促进肾上腺素能肿瘤细胞增殖的潜在机制。
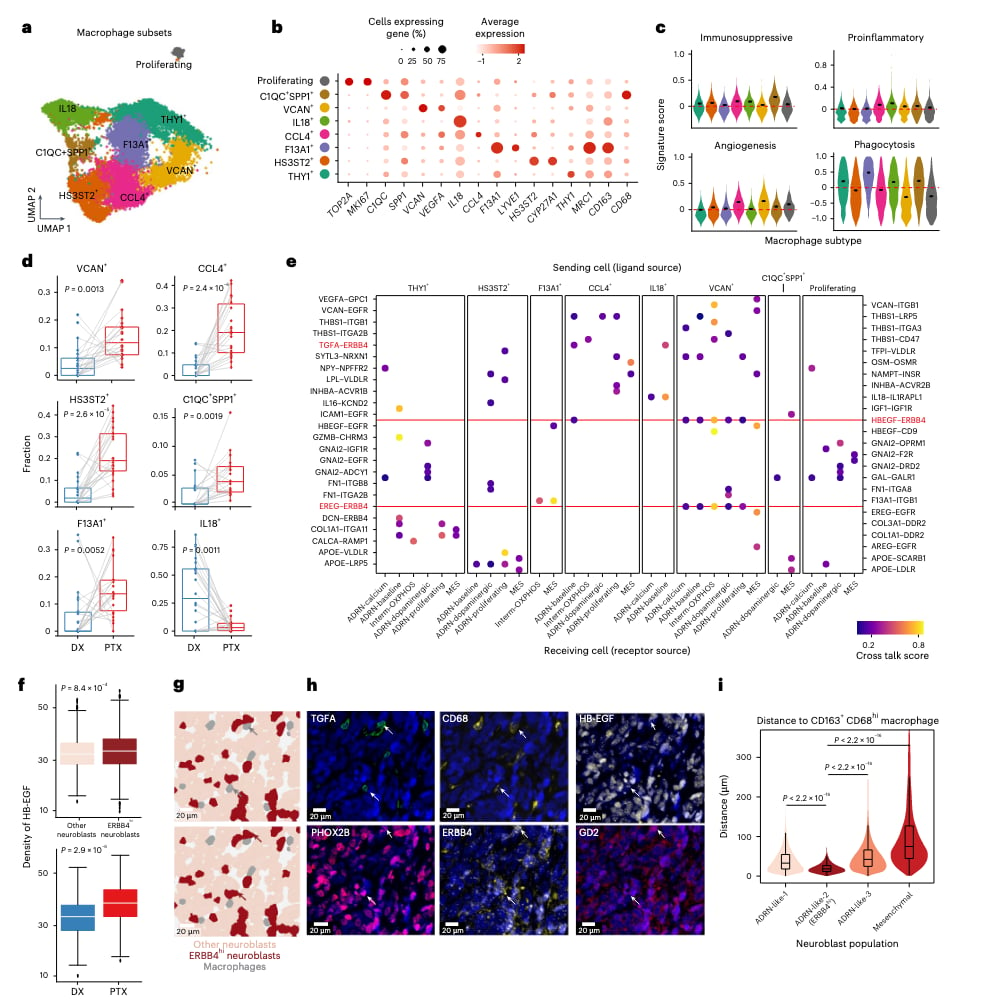
图4: 对TAM进行分群注释及进一步分析,得到7种不同的TAM状态细胞群,分析了这些细胞群在治疗前后的分布(d),预测了TAM与肿瘤细胞的相互作用(e),CODEX空间蛋白质组学共检测(g)(h)。
为了在体内环境中进一步探究TAM与肿瘤细胞的相互作用,研究人员构建了小鼠神经母细胞瘤模型,并使用Xenium空间转录组学技术进行检测。在小鼠模型中验证了此前在人体样本中鉴定的多种细胞表型,并通过空间配体-受体分析证实了预测的相互作用,初步证明了人类神经母细胞瘤微环境的关键特征在小鼠模型中也存在。
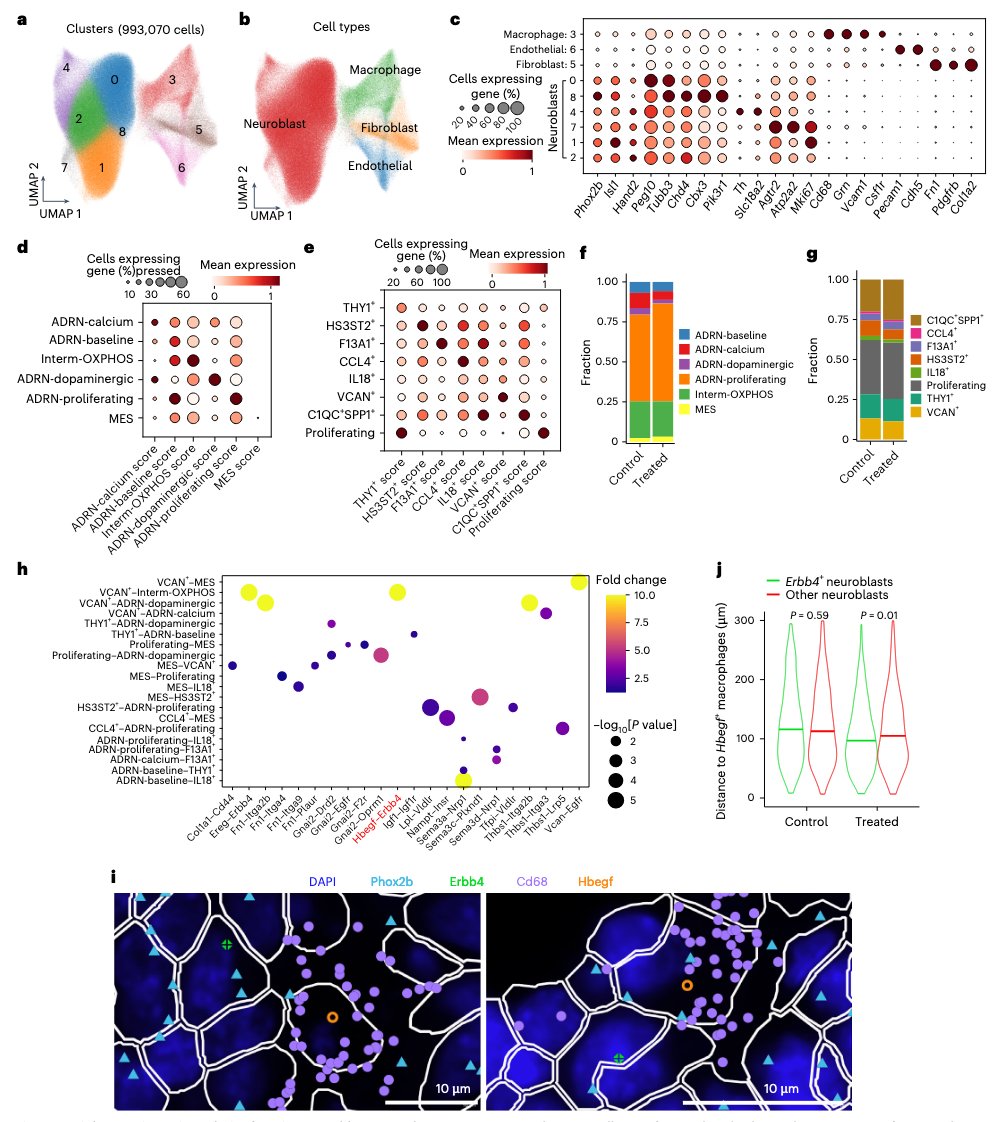
图5: Xenium技术验证神经母细胞瘤表型。
基于得到验证的配体-受体相互作用,研究人员假设在ADRN肿瘤状态下,TAM通过激活ErbB受体酪氨酸激酶导致细胞增殖和耐药性。鉴于HB-EGF在化疗后普遍高表达,研究推断HB-EGF与ErbB通路具有协同作用。通过将5种神经母细胞瘤细胞系与THP-1巨噬细胞共培养的细胞实验发现,共培养显著增加了THP-1巨噬细胞的HB-EGF表达。对共培养上清液进行ELISA检测证实,THP-1巨噬细胞主要分泌HB-EGF配体,支持HB-EGF是活性配体。此外,共培养的神经母细胞瘤细胞的ERBB4受体磷酸化显著增加,提示HB-EGF / ERBB4信号可能介导了神经母细胞瘤细胞与TAM的相互作用。进一步实验使用3种神经母细胞瘤细胞系进行共培养和单培养,确定巨噬细胞产生的HB-EGF激活了下游ERK信号,推测ErbB信号通过RAS–RAF–MEK–ERK通路调控细胞活动,并有助于肿瘤细胞存活。为了评估TAM与肿瘤细胞相互作用对肿瘤细胞表型的影响,研究对共培养的神经母细胞瘤细胞系进行了scRNA测序。结果显示,共培养后肿瘤细胞发生的改变与经历标准化治疗后类似,而加入HB-EGF抑制剂CRM197后,这一进程被阻断。
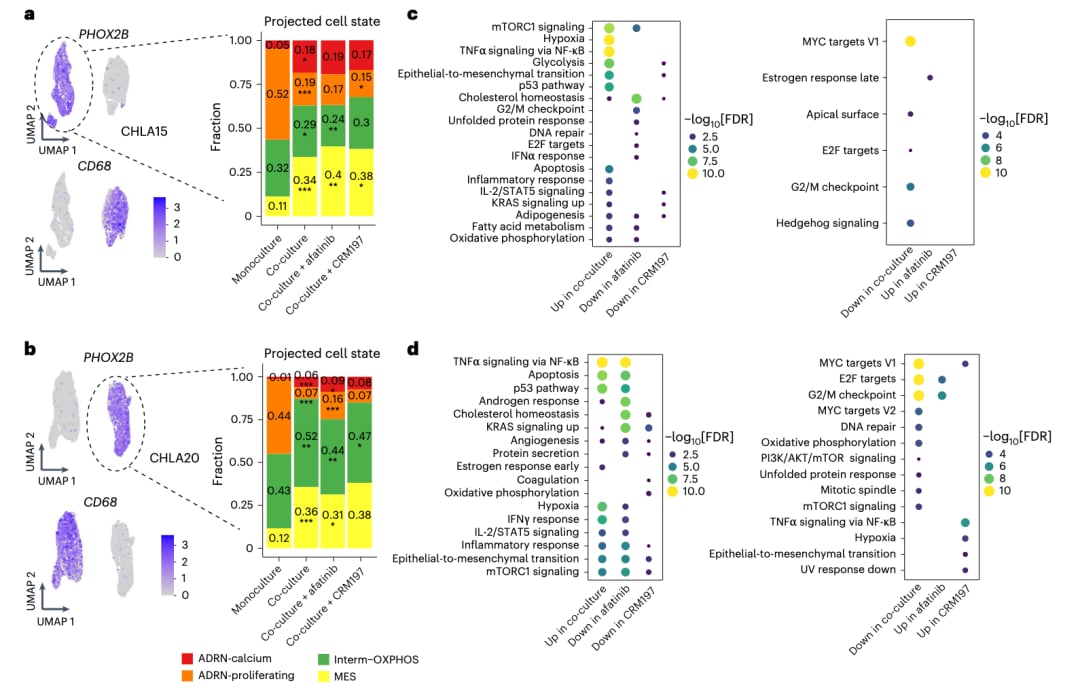
图7: 单培养/共培养的神经母细胞瘤细胞与巨噬细胞,显示不同的细胞状态比例与通路富集信息。
总结:这项研究通过对高危神经母细胞瘤患者配对样本进行单细胞多组学分析,首次系统揭示了诱导化疗如何重塑肿瘤微环境。研究深入剖析了肿瘤相关巨噬细胞在其中的关键作用,并鉴定出HB-EGF及其激活的ErbB/ERK通路是介导肿瘤细胞与巨噬细胞相互作用、促进肿瘤增殖和产生耐药性的重要分子机制。这项发现为理解神经母细胞瘤的复杂耐药性提供了重要的理论基础,并为未来开发针对肿瘤微环境或HB-EGF/ErbB/ERK通路的靶向药或抗癌药提供了潜在方向。
对于正在寻找最新抗癌药物信息或海外购药途径的患者和家属,了解这类前沿研究进展至关重要。如果您对神经母细胞瘤或其他癌症的治疗药物、靶向药、仿制药感兴趣,或者需要获取海外药品,可以访问[MedFind提供的药品代购服务](https://medfind.link/shop)。同时,MedFind还提供[专业的AI问诊服务](https://medfind.link/ai)和丰富的[抗癌资讯](https://medfind.link/info),帮助您获取更全面的信息和支持。





