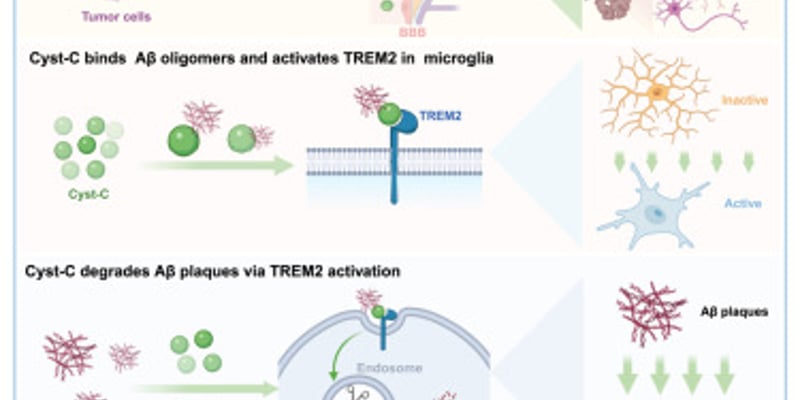
胰腺癌,尤其是转移性胰腺导管腺癌(PDAC),是一种预后极差的恶性肿瘤。长期以来,一线治疗方案的突破相对有限,患者迫切需要更有效的新疗法来延长生存期。近日,一项重要的临床试验结果为胰腺癌患者带来了新的希望。
根据Actuate Therapeutics公司公布的Actuate-1801 II期临床试验(NCT03678883)Part 3B部分的最新顶线数据,在未经治疗的转移性PDAC患者中,将GSK-3β抑制剂elraglusib(9-ING-41,依拉格鲁西)加入到标准的吉西他滨(gemcitabine)联合白蛋白紫杉醇(nab-paclitaxel,商品名:爱博新/Abraxane)化疗方案中,与单纯化疗相比,显著提高了患者的总生存期(OS)。
这项研究达到了其主要终点,数据显示,联合治疗组患者的中位总生存期和1年总生存率均有统计学意义上的显著改善。同时,elraglusib联合吉西他滨和白蛋白紫杉醇方案的风险-获益特征表现良好。
Actuate Therapeutics公司总裁兼首席执行官Daniel Schmitt表示:“胰腺癌是最具侵袭性且最难治疗的恶性肿瘤之一,患者急需新的治疗选择。十多年来,转移性胰腺癌一线治疗在改善生存方面没有取得重大进展。这项II期试验中,elraglusib联合方案在显著提高中位OS和达到1年及以上生存率的患者比例的同时,还显示出良好的风险-获益特征,这进一步证明了elraglusib有望改变转移性胰腺导管腺癌的治疗格局。”
他进一步指出:“我们非常期待在2025年ASCO年会上公布完整的顶线数据。基于联合治疗组迄今为止观察到的显著生存期改善,我们期待在今年下半年与美国和欧盟的监管机构合作,规划elraglusib的新药申请(NDA)和注册路径,并尽快将药物提供给患者。”
Actuate-1801是一项评估elraglusib在难治性癌症患者中的I/II期研究。该研究分为三个部分:
- Part 1:elraglusib单药剂量爬坡,确定最大耐受剂量(MTD)和II期推荐剂量(RP2D)。
- Part 2:elraglusib联合标准抗癌药物进行剂量爬坡,确定MTD和RP2D。
- Part 3:随机部分,在既往未经治疗的局部晚期或转移性胰腺癌患者中,评估elraglusib联合吉西他滨和白蛋白紫杉醇方案对比单纯化疗。
在Part 3研究中,入组患者需年满18岁,根据RECIST 1.1标准至少有一个可测量病灶。其他关键入组标准包括:足够的骨髓、肝脏和肾脏功能;ECOG体力状态评分为0至1分。允许在辅助治疗中接受氟尿嘧啶或吉西他滨作为放疗增敏剂,但需在入组前至少6个月完成。新辅助FOLFIRINOX方案也允许,但末次给药需在入组前至少6个月。
排除标准包括:内分泌或腺泡性胰腺癌;显著心血管功能障碍;首次研究治疗前12周内发生心肌梗死;有症状、快速进展的脑转移或软脑膜受累。值得注意的是,入组前7天内进行过大型手术或计划在研究期间进行大型手术的患者也被排除在外。
在Part 3B部分,共纳入286名患者,按2:1的比例随机分配至elraglusib联合吉西他滨和白蛋白紫杉醇组或单纯吉西他滨和白蛋白紫杉醇组。联合治疗组患者在每个28天周期的第1天接受9.3 mg/kg剂量的elraglusib,同时接受标准的吉西他滨和白蛋白紫杉醇化疗。
除了主要终点总生存期(OS),次要终点还包括总缓解率(ORR)、疾病控制率(DCR)、无进展生存期(PFS)和安全性。
这项研究结果为转移性胰腺癌的一线治疗带来了新的希望,elraglusib联合化疗方案有望成为未来的标准治疗之一。
如果您或您的家人正在寻找针对胰腺癌或其他癌症的靶向药、抗癌药,或希望了解海外新药的获取途径,可以访问我们的网站。我们提供专业的海外靶向药代购服务,帮助患者获取所需的药物。
同时,面对复杂的癌症信息和治疗方案,我们的AI问诊服务可以提供智能化的初步咨询,辅助您更好地理解病情和治疗选择。您也可以在我们的抗癌资讯板块查找更多关于癌症治疗、药物信息、临床研究等方面的专业科普文章和诊疗指南。
Pancreatic Cancer | Image Credit:
© magicmine – stock.adobe.com