免疫检查点阻断(ICB)疗法,作为一类重要的抗癌药和靶向药,为许多癌症患者带来了新的希望,尤其是在实体瘤治疗领域。然而,并非所有患者都能从中获得长期的生存益处,治疗耐药性仍然是临床上面临的巨大挑战。识别预测患者预后的生物标志物一直是研究的重点,但大多数现有标志物基于原发肿瘤分析,对于ICB治疗的反应预测仍不尽如人意。这提示我们,癌症治疗不应仅关注原发病灶,而应将身体视为一个完整的系统,特别是考虑肿瘤转移对治疗结果的影响。
近年来,研究人员逐渐认识到,肿瘤转移的器官环境对ICB治疗效果有着显著影响。肿瘤细胞会主动适应不同器官的微环境,导致恶性表型和治疗反应的异质性。例如,肝转移通常更具侵袭性且对治疗抵抗性更强,而淋巴结转移可能对ICB反应更好。这些器官特异性调节的概念在癌症免疫学领域日益受到重视。

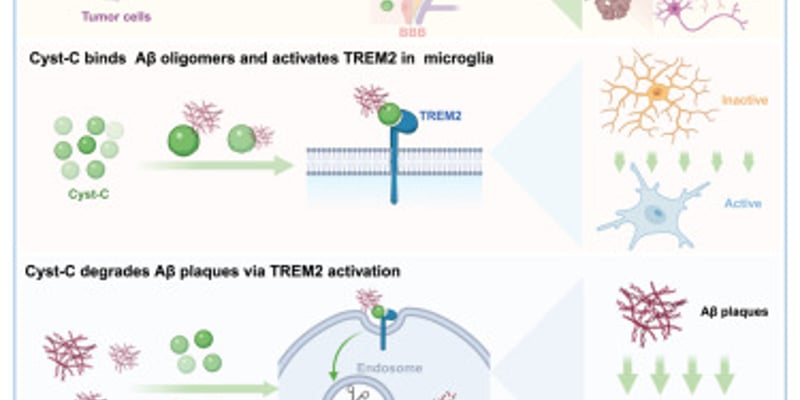
骨骼是癌症常见的转移部位,尤其在乳腺癌、前列腺癌和肺癌等多种癌症中。临床观察发现,存在骨转移的患者往往对ICB治疗反应较差。既往研究已发现骨转移病灶具有独特的肿瘤微环境,例如骨吸收释放的TGF-β可能抑制Th1分化并促进Th17极化,从而导致ICB耐药。此外,骨转移灶富含产生CCL20的炎性单核细胞,会损害CD8+ T细胞功能。

机理模式图(图源自Cancer Cell)
在一项发表于《Cancer Cell》的最新研究中,研究人员深入探究了骨转移影响ICB疗效的机制。他们在多个临床队列和多种小鼠模型中观察到,骨转移的存在确实会诱导骨外肿瘤对ICB产生耐药性。进一步的机制研究揭示,这种“长距离”的免疫抑制效应是由骨转移灶中产生骨桥蛋白(Osteopontin, OPN)的破骨细胞介导的。OPN通过血液循环到达骨外肿瘤部位,重塑当地的肿瘤微环境,并损害对ICB疗效至关重要的CD8+ TCF1+前体细胞的募集和分化。
这项研究令人振奋的发现是,在小鼠模型中,通过阻断破骨细胞生成(例如使用αRANKL阻断剂)、中和循环中的OPN,或特异性清除破骨细胞中的OPN,可以恢复ICB的治疗反应性。αRANKL阻断剂与ICB联合治疗方案的作用模式和治疗效果也在临床队列中得到了初步验证。这些发现强有力地证实了骨骼是一个被肿瘤转移利用的、具有特异性免疫调节功能的器官,并提示靶向破骨细胞形成可能是改善骨转移癌症患者ICB治疗预后的一个有前景的策略。
这项研究不仅揭示了骨转移导致免疫治疗耐药的新机制,也为开发新的联合治疗方案提供了理论基础。对于正在寻求最新抗癌药、靶向药或仿制药信息的患者及其家属,了解这些前沿研究进展至关重要。如果您对海外靶向药代购、仿制药购买途径感兴趣,或者希望获取专业的AI问诊服务以更好地了解病情和治疗方案,可以访问MedFind网站。MedFind提供海外靶向药代购服务,并汇集了丰富的药物信息、诊疗指南等抗癌资讯,以及便捷的AI问诊平台,帮助患者获取更全面的抗癌资源。