摘要
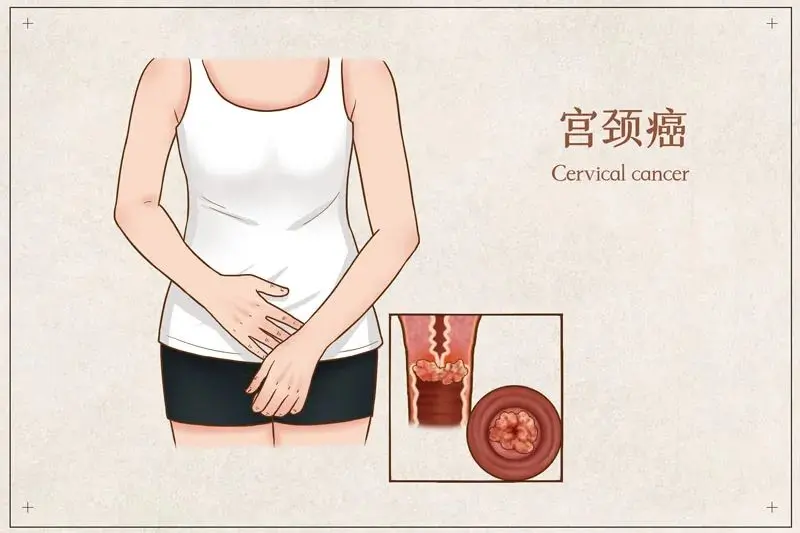
近日,美国食品药品监督管理局(FDA)已完全批准Tivdak(Tisotumab vedotin-tftv)用于治疗化疗期间或化疗后疾病进展的复发性或转移性宫颈癌患者。

关键信息如下:
近日,美国食品药品监督管理局(FDA)已完全批准Tivdak(Tisotumab vedotin-tftv)用于治疗化疗期间或化疗后疾病进展的复发性或转移性宫颈癌患者。
摘要
近日,美国食品药品监督管理局(FDA)已完全批准Tivdak(Tisotumab vedotin-tftv)用于治疗化疗期间或化疗后疾病进展的复发性或转移性宫颈癌患者。


关键信息如下:
近日,美国食品药品监督管理局(FDA)已完全批准Tivdak(Tisotumab vedotin-tftv)用于治疗化疗期间或化疗后疾病进展的复发性或转移性宫颈癌患者。