对于无数癌症患者和家庭来说,每一次科研突破都如同一束希望之光。在众多癌症类型中,携带p53基因突变的肿瘤常常被认为是治疗的“顽固堡垒”,因其普遍存在且对传统疗法抵抗力较强,给临床治疗带来了巨大挑战。然而,近期一项由中国科学家团队在《自然化学生物学》(Nature Chemical Biology)杂志上发表的重磅研究,为这一困境带来了新的曙光!他们发现了一种全新的治疗策略,通过靶向一个名为胸腺嘧啶DNA糖基化酶(TDG)的关键蛋白,并开发出全球首创的小分子抑制剂C-271,不仅能选择性杀伤p53缺陷型癌细胞,还能有效激活患者自身的先天免疫系统,为p53突变癌患者开启了精准治疗的新篇章。MedFind始终关注全球抗癌前沿,致力于将最及时、最准确的药物信息和治疗方案分享给您。
p53基因突变:癌症治疗的“顽固堡垒”与一线生机
要理解这项研究的重大意义,我们首先需要了解p53基因以及它在癌症中的角色。
什么是p53基因?它为何如此重要?
p53基因常被称为“基因组的守护者”,因为它在人体内扮演着极其关键的角色。想象一下,您的身体有一套精密的细胞生长和分裂控制系统,而p53基因就是这套系统的“总开关”或“刹车踏板”。它的主要职责是:
- 检查DNA损伤: 当细胞的DNA受到损伤时(例如,受到环境污染、辐射或细胞自身代谢产物的影响),p53会立即被激活。
- 修复或清除受损细胞: 一旦激活,p53会尝试修复受损的DNA。如果修复成功,细胞可以继续正常生长;如果损伤过于严重无法修复,p53就会启动细胞的“自杀”程序(即细胞凋亡),确保这些带有错误基因的细胞不会继续分裂,从而防止它们癌变。
简而言之,正常的p53基因就像一个尽职尽责的“巡警”,时刻保护着细胞的健康,阻止“坏分子”——癌细胞的形成和扩散。
p53突变意味着什么?为何治疗如此困难?
不幸的是,p53基因是人类癌症中最常发生突变的基因之一,据统计,超过50%的人类癌症都携带着p53基因的突变。当p53基因发生突变时,这个“巡警”就失去了它的功能,甚至可能变成“帮凶”:
- 细胞失去“刹车”: 癌细胞不再受控,可以自由、快速地生长和分裂,形成肿瘤。
- 药物抵抗: 许多传统的化疗和放疗药物正是通过损伤DNA来杀死癌细胞的。但如果癌细胞失去了p53这个“守门员”,它们可能对这些损伤不再敏感,从而产生耐药性,让治疗效果大打折扣。
- 预后不佳: p53突变往往与更具侵袭性的肿瘤、更高的复发率和更差的患者预后相关。
因此,找到一种能够有效针对p53突变癌细胞的治疗方法,一直是癌症研究领域的一个重大挑战。传统的靶向治疗很难直接作用于突变的p53本身,因为突变后的p53往往失去了原有的结构和功能,难以被药物“识别”。患者迫切需要新的、更聪明、更精准的治疗策略。
TDG酶:被忽视的DNA修复“管家”与抗癌新靶点
这项新研究的焦点之一,就是一种长期以来在抗癌领域相对“低调”的酶——胸腺嘧啶DNA糖基化酶(TDG)。
TDG究竟是什么?它在人体内扮演什么角色?
TDG全称胸腺嘧啶DNA糖基化酶,顾名思义,它是一种负责处理DNA中特定“糖基化”错误的酶。您可以把TDG想象成DNA的“高级维修工”或“清洁工”,它的核心功能包括:
- DNA修复(碱基切除修复,BER): 我们的DNA每天都会受到各种内外因素的损伤,其中一些损伤会导致DNA碱基发生错误配对或化学修饰。TDG能特异性地识别并移除DNA中不正常的碱基(如G•T、G•U错配中的嘧啶碱基,以及由TET双加氧酶氧化5-甲基胞嘧啶产生的5-甲酰胞嘧啶和5-羧基胞嘧啶),启动后续的修复过程,确保DNA的完整性和准确性。
- DNA去甲基化(表观遗传调控): 除了直接修复损伤,TDG还参与DNA去甲基化过程,这是一个重要的表观遗传学调控机制。简单来说,DNA甲基化就像在基因上贴上“开/关”标签,决定基因是否表达。TDG通过移除一些甲基化的衍生物,帮助调节基因的“开关”,从而影响细胞的功能和特性。
- 转录调控: 此外,研究还发现TDG能够通过招募其他共激活因子,间接参与基因的转录过程,影响哪些基因被“阅读”并转化为蛋白质。
可以说,TDG在维持基因组稳定性、调控基因表达以及胚胎发育等多种生物学过程中都发挥着不可或缺的作用。
TDG与癌症:一个复杂的“双面角色”
虽然TDG的功能强大,但它在肿瘤发生发展中的具体作用机制,以及它是否可以成为一个有效的治疗靶点,此前一直没有被完全明确。研究显示,TDG在癌症中可能扮演着一个复杂的“双面角色”:
- 有些研究表明,降低TDG的活性可以抑制结直肠癌和黑色素瘤癌细胞的生长,提示它可能具有促癌作用。
- 而另一些研究则发现,在肝细胞癌和肠道腺瘤的小鼠模型中,缺失TDG反而会促进肿瘤的发生,这又似乎说明它具有抑癌功能。
这种看似矛盾的现象,正说明了TDG在不同癌症类型和病理背景下的功能差异性,也促使科学家们深入思考:TDG是否在某些特定的遗传背景下,会成为癌细胞的“阿喀琉斯之踵”?特别是当癌细胞的某个关键基因(比如p53)已经出现问题时,抑制TDG是否能导致癌细胞的死亡?这正是“合成致死”概念的切入点。
合成致死:精准打击癌细胞的“阿喀琉斯之踵”
“合成致死”是癌症靶向治疗领域一个非常巧妙且充满前景的策略。这项研究的核心突破,正是发现了TDG与p53之间存在“合成致死”关系。
什么是“合成致死”?像一把“双刃剑”只伤敌不伤己?
“合成致死”是一个听起来有些专业的词汇,但它的核心原理非常简单且巧妙。您可以把它想象成以下场景:
假设您的汽车有两个独立的备用系统A和B。通常情况下,如果系统A坏了,系统B可以接替工作,汽车还能正常行驶;如果系统B坏了,系统A也能单独运行。但如果系统A和系统B同时都坏了,那么汽车就会彻底抛锚,无法启动。
在癌症治疗中,“合成致死”的原理与之类似:
- 当两个基因(或蛋白)中的任何一个单独失活时,细胞(包括癌细胞和正常细胞)仍然可以存活。
- 但是,如果这两个基因(或蛋白)同时失活,细胞就会死亡。
这种策略之所以高明,是因为许多癌细胞本身就已经发生了一些基因突变(例如,p53基因突变),相当于其中一个“备用系统”已经失效了。如果这时我们再用药物去抑制与这个突变基因存在“合成致死”关系的另一个基因,就能选择性地杀死癌细胞,而对拥有完整两个“备用系统”的正常细胞影响较小,从而大大降低治疗的副作用,实现“精准打击”。它就像一把“双刃剑”,但却能只伤敌不伤己。
成功的先例:PARP抑制剂与BRCA突变
“合成致死”策略在临床上已经取得了显著的成功,最著名的例子就是PARP抑制剂在BRCA基因突变肿瘤中的应用。
- BRCA基因是另一种重要的DNA修复基因。当BRCA基因发生突变时,细胞修复DNA双链断裂的能力会下降,这就像汽车的第一个备用系统坏了。
- 聚腺苷二磷酸核糖聚合酶(PARP)是细胞修复DNA单链断裂的关键酶,它相当于汽车的第二个备用系统。
- 对于BRCA突变的癌细胞来说,它们的双链修复功能已经受损,如果再用PARP抑制剂(如奥拉帕利(点击查看购买渠道与价格))去阻断PARP,导致单链断裂也无法修复,那么癌细胞就会因为DNA损伤过度而死亡。
这个成功的例子充分证明了“合成致死”策略的巨大潜力,也激励着科学家们寻找更多存在“合成致死”关系的基因对,为不同类型的癌症开发新的治疗方法。
C-271:TDG抑制剂如何精准瓦解p53突变癌?
在这项突破性研究中,中国科学院分子细胞科学卓越创新中心的杜雅蕊、徐国良教授团队,联合上海交通大学张良教授和赛岚医药科技有限公司吴海平博士团队,正是发现了TDG与p53之间存在这种关键的“合成致死”关系,并成功开发出了首创的小分子抑制剂C-271。
C-271的作用机制:从TDG到免疫激活
这项研究深入揭示了C-271如何精准打击p53缺陷型癌细胞的复杂机制,我们可以将其分解为几个关键步骤:
- 靶向TDG,破坏其功能: 科学家们设计并开发了C-271,这是一种小分子抑制剂。它能够共价结合TDG,简单来说就是像一把“钥匙”插入“锁孔”一样,牢牢地与TDG结合,从而破坏TDG与DNA结合的能力,使其无法正常发挥DNA修复等功能。
- TDG与p53的“协同作用”: 关键的发现是,TDG和p53在正常细胞中并非完全独立工作,它们实际上有一个“合作”任务:共同促进一种名为RNA解旋酶DHX9的转录。DHX9的作用是解旋细胞内形成的双链RNA(dsRNA),防止其过度积累。您可以把DHX9想象成一个“清道夫”,负责清理细胞内的“垃圾”——异常形成的dsRNA。
- p53缺陷+TDG抑制 = DHX9下调: 在p53缺陷的癌细胞中,其中一个“合作伙伴”(p53)已经失效了。如果此时我们再用C-271去抑制另一个“合作伙伴”(TDG),那么它们共同促进DHX9转录的功能就会受到严重影响,导致DHX9的水平显著下调。
- 异常dsRNA积累: 随着DHX9这个“清道夫”的减少,细胞内异常的双链RNA(dsRNA)就会开始大量积累。这些dsRNA就像细胞内的“警报信号”,它们的出现通常意味着病毒感染或其他严重的细胞应激。
- 激活先天免疫系统: 当异常dsRNA积累到一定程度时,它们会激活细胞内一套强大的“报警系统”,即RIG-I/MDA5–MAVS感知通路。这个通路是先天免疫系统的重要组成部分,它负责识别并应对细胞内的危险信号,从而启动免疫反应。
- 肿瘤抑制并增强抗肿瘤免疫: 一旦RIG-I/MDA5–MAVS通路被激活,细胞就会进入一种“抗病毒”或“抗感染”的状态,但这在癌细胞中,却意外地触发了强大的抗肿瘤效应:一方面直接抑制了癌细胞的生长和增殖,另一方面也增强了机体自身的抗肿瘤免疫反应,让免疫系统能够更好地识别并攻击癌细胞。
整个过程就像是C-271拆除了癌细胞的“防护墙”,然后让癌细胞内部的“警报系统”响起来,最终引来了免疫“援兵”对癌细胞进行围剿。

临床前研究的振奋结果:选择性杀伤与显著疗效
这项研究不仅阐明了C-271的作用机制,更通过大量的临床前实验验证了其显著的治疗效果:
- 选择性杀伤:C-271在p53缺陷型肿瘤模型中表现出优异的选择性,能够有效杀伤缺少p53的癌细胞,而对p53功能正常的细胞影响较小。这大大降低了药物对正常组织的毒副作用,符合精准医疗的理念。
- 显著的治疗效果: 在体外细胞实验和体内动物模型中,C-271都显示出显著的肿瘤抑制作用。这意味着它在抑制肿瘤生长、缩小肿瘤体积方面具有巨大潜力。
这些令人振奋的临床前研究结果,为p53缺陷型癌症的治疗提供了一个全新的、富有希望的策略。
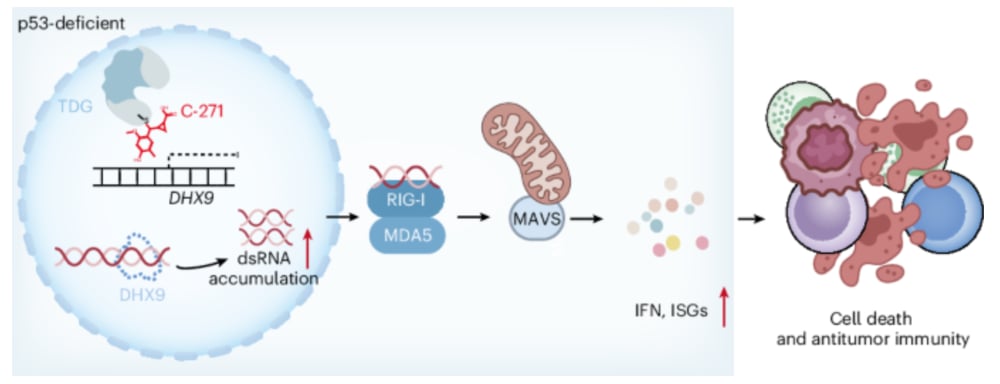
模式流程图(图片源自Nature Chemical Biology)
新疗法带来的深远意义与未来展望
这项关于TDG抑制剂C-271的研究,无疑是癌症治疗领域的一大突破,它为无数p53突变癌患者带来了新的希望。
突破性的研究成果:为p53突变癌患者点燃希望
这项研究的意义不仅在于发现了一个新的药物靶点和抑制剂,更重要的是它:
- 开辟了p53突变癌治疗的新思路: 长期以来,p53突变癌一直是治疗难点。这项研究通过巧妙地利用“合成致死”原理,绕开了直接修复或替代p53的难题,转而通过抑制TDG,间接实现对p53缺陷型癌细胞的精准打击。
- 结合免疫激活,疗效有望更优: C-271不仅直接杀伤癌细胞,更通过激活先天免疫系统,有望与其他免疫检查点抑制剂等免疫疗法产生协同作用,进一步提升治疗效果。这种“双管齐下”的策略,预示着未来的联合治疗方案可能带来更好的临床结果。
- 提供了新颖的药物开发方向: C-271作为首创的TDG小分子抑制剂,为后续的药物研发提供了宝贵的经验和方向。
从实验室到临床:C-271的下一步
尽管这项研究成果令人鼓舞,但我们也需要清醒地认识到,目前C-271仍处于临床前研究阶段。这意味着它还需要经过严格的临床试验(包括I期、II期、III期),以在人体中充分验证其安全性、有效性、最佳剂量以及可能出现的副作用。
从实验室的发现到最终获得审批并用于患者,通常是一个漫长而严谨的过程,但每一步都充满希望。MedFind将持续关注C-271以及类似前沿研究的进展,及时为您更新最新的临床试验信息和药物动态。
MedFind:陪伴您抗癌路上的可靠伙伴
在面对复杂且不断变化的抗癌之路时,获取专业、准确、及时的信息至关重要。MedFind作为由癌症患者家属发起的平台,深知您所经历的焦虑与挑战。我们致力于成为您抗癌路上的坚实后盾:
- 权威抗癌资讯: 我们紧密追踪全球最新的抗癌研究、药物进展和诊疗指南,并将其转化为通俗易懂的中文科普文章,帮助您了解前沿医学知识。
- 药物信息共享: 详细介绍各种抗癌药物的机制、疗效、副作用、国内外上市情况,让您对治疗方案有更全面的认知。
- AI辅助问诊: 利用先进的AI技术,为您提供初步的、个性化的问诊支持,解答您关于疾病和治疗的疑惑。
- 海外购药渠道: 对于国内尚未上市的创新药物,MedFind致力于帮助患者构建安全、合规的海外购药渠道,确保您能及时获得所需的抗癌药品。
像C-271这类处于早期研发阶段的创新疗法,虽然尚未进入临床,但代表了未来抗癌的希望。MedFind会持续跟踪这类创新成果,并争取在未来能够为患者提供相关的药物信息及潜在获取途径,让您不再孤单前行。
TDG抑制剂C-271的发现,为p53突变型癌症的治疗带来了全新的视角和强大的工具。尽管尚需时日才能走向临床,但它无疑点燃了患者心头的希望之火,预示着精准靶向和免疫激活的联合策略将在未来发挥更大作用。面对癌症,每一次突破都值得我们关注和期待。MedFind将一如既往地与您并肩,提供最新、最全面的抗癌信息和支持。如果您对p53突变癌的治疗或C-271等前沿研究有任何疑问,或需要了解更多抗癌药物和治疗方案,欢迎随时访问MedFind平台或联系我们的专业团队进行咨询,共同探索更有效的抗癌之路。





