“癌症”二字对于无数患者和家庭而言,意味着一场艰巨的战斗。幸运的是,随着医学科技的飞速发展,科学家们正不断深入探索癌症的奥秘,试图找到更精准、更有效的治疗方法。近期,《Science》杂志刊登的一项重磅研究,就为我们带来了令人振奋的好消息!这项研究首次详细揭示了BRAF突变这个癌症“开关”的工作原理,不仅让我们对癌细胞如何生长有了更深刻的理解,更为未来开发针对BRAF突变的靶向治疗药物指明了方向,为广大癌症患者带来了新的希望。
癌症背后的“开关”:RAS-ERK通路与BRAF突变
我们人体内的每一个细胞都像一台精密的机器,其增殖、分化等生命活动都受到严格的调控。其中,一套名为“RAS-细胞外信号调节激酶(ERK)”的信号通路,就是细胞生长和发育的关键指挥系统。当这个通路正常工作时,细胞就能有条不紊地执行任务;但如果这个通路失控,细胞就会开始无限制地增殖,形成肿瘤,也就是我们常说的癌症。
在癌症发生发展中,BRAF基因的突变是一个非常常见的“罪魁祸首”。BRAF是RAS-ERK通路中的一个重要成员,它就像一个控制系统核心部件,负责传递信号。当BRAF基因发生突变时,它就会像一个“失灵的开关”一样,持续地发出激活信号,导致RAS-ERK通路过度活跃,最终推动肿瘤的生长。据统计,这类BRAF突变在多种癌症中都非常常见,例如黑色素瘤、甲状腺癌、结直肠癌等。
《Science》重磅突破:BRAF致癌突变的三维结构揭秘
为了更好地理解并找到对抗BRAF突变的方法,科学家们一直在努力解析它的“长相”和“行为模式”。加拿大蒙特利尔大学Marc Therrien团队的一项开创性研究,终于在《Science》杂志上在线发表,取得了重大突破。他们利用一种名为“冷冻电子显微镜”的尖端技术(想象成一台能把微小分子拍得一清二楚的超高分辨率相机),首次成功解析了三种关键致癌性BRAF突变的三维结构,其中包括最常见、影响最广泛的BRAF V600E突变。
这项研究的意义在于,我们现在能以前所未有的清晰度,看到这些致癌突变体的真实形态,以及它们是如何通过改变自身结构来“逃脱”身体的正常调控,从而持续激活癌症通路的。这就像我们终于看到了癌细胞赖以生存的“核心秘密”,为我们找到了击破它的关键。就像我们了解了锁的结构,才能更有效地制造出匹配的钥匙。

揭开“癌变开关”的真面目:BRAF的自身抑制与激活机制
正常情况下,BRAF分子具有一种“自身抑制”的状态,就像一个处于“待机模式”的开关,不会随意启动。这种抑制状态是通过其内部不同区域(富含半胱氨酸的结构域CRD和激酶结构域KD)之间的相互作用来维持的。只有当它接收到特定的激活信号时,BRAF才会解除自身抑制,形成一个“二聚体”(两个BRAF分子结合在一起),从而启动信号通路。
然而,研究发现,那些致癌性的BRAF突变,例如V600E突变,就像是在BRAF分子内部植入了一个“作弊器”。这些突变会破坏野生型BRAF的这种自身抑制状态,使得激酶结构域(KD)在没有外部信号的情况下,也强行转变为一种“预先激活”的构象。科学家们特别注意到,这种结构上的变化很可能是由BRAF分子内一个被称为“αC螺旋”的区域发生了位移引起的。简单来说,这个αC螺旋就像一个关键的“零件”,它的位置稍微一变,整个BRAF分子就从“待机”状态直接跳到了“全速运转”的致癌状态。
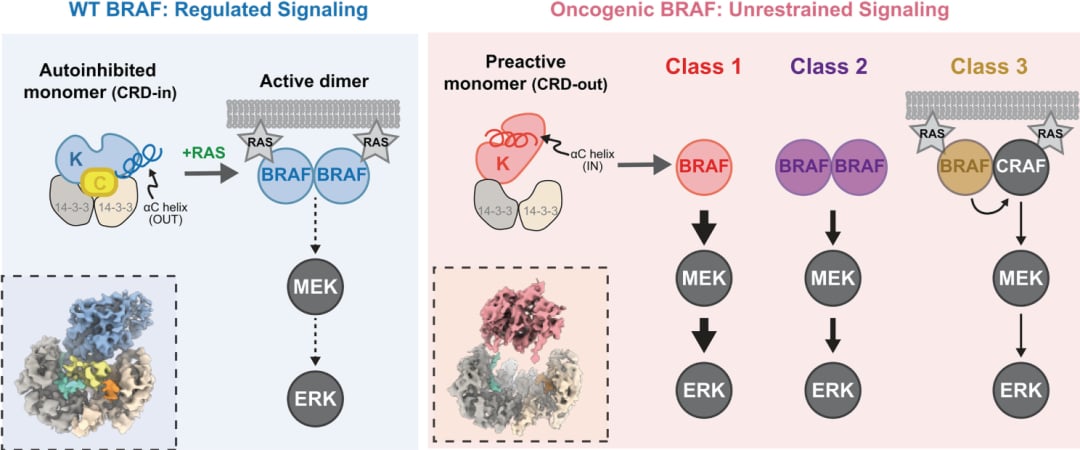
对致癌型 BRAF 变体(红色阴影部分)与野生型 BRAF(蓝色阴影部分)的冷冻电子显微镜结构分析表明,这些变异体的活性不受限制(图源自Science)
小分子PLX8394如何“制服”致癌蛋白?
这项研究不仅揭示了致癌BRAF突变的激活机制,更重要的是,它为如何“关闭”这个失控的开关提供了明确的思路。科学家们发现,小分子抑制剂PLX8394能发挥关键作用。这种药物能够将之前提到的“αC螺旋”稳定在无活性的构象中,有效地恢复致癌性BRAF的自身抑制状态。这意味着,即便BRAF发生了致癌突变,PLX8394也能像一把精准的“锁”,将这个失控的“开关”重新固定回“关闭”或“待机”状态,阻止其继续驱动癌细胞生长。
这项发现不仅解释了为什么像PLX8394这类化合物能够有效地抑制BRAF突变的肿瘤,也进一步证实了所有致癌性BRAF突变(包括V600E以及其他第2类和第3类突变)都遵循一种共同的激活机制:它们通过解除自身抑制,并导致αC螺旋向内移动来形成类似活性的结构。这种共同的机制,为开发更广谱、更有效的BRAF靶向治疗药物奠定了坚实的基础。
这项研究对癌症患者意味着什么?
这项发布在《Science》上的研究成果,无疑为无数正在与癌症抗争的患者及其家属带来了巨大的希望。它的价值体现在以下几个方面:
- 更精准的药物设计:通过了解致癌BRAF突变的具体三维结构和激活机制,科学家们能够更精准地设计出新型靶向药物。这些药物可以像“量身定制”的钥匙一样,更有效地结合到BRAF突变蛋白上,将其“锁住”,从而最大程度地抑制癌细胞的生长,同时减少对正常细胞的伤害。
- 克服耐药性的潜力:许多靶向药物在初期效果显著,但癌细胞往往会发展出耐药性。深入理解BRAF的激活机制,有助于研发能克服现有耐药性的新一代药物,延长患者的生存期。
- 未来治疗方案的基石:这项研究建立了一个统一的结构和机制框架,解释了不同类型致癌性BRAF突变的作用模式。这意味着未来针对BRAF的治疗可能不再是“一药一突变”,而是可能找到能覆盖多种BRAF突变类型的广谱药物,惠及更广泛的患者群体。
- 为患者提供更多选择:虽然这项研究还处于基础科学阶段,尚未直接产生新的上市药物,但它是新药研发链条中至关重要的一环。它极大地加速了潜在靶向疗法的开发进程,让患者在未来有更多、更有效的治疗选择。
对于那些被诊断出带有BRAF突变的患者,如黑色素瘤、甲状腺癌、结直肠癌等,这项研究带来的不仅仅是科学上的进步,更是对生命延续的希望。MedFind平台一直致力于追踪全球最新的抗癌研究进展和药物信息,并将这些前沿资讯第一时间传递给您。我们深知患者和家属在寻找治疗方案时的焦虑与不易,因此,我们希望通过分享这类重磅研究,让大家对未来充满信心。
总而言之,这项《Science》研究通过揭示BRAF致癌突变的共同激活机制,为癌症的靶向治疗开辟了新的道路。它让我们看到了小分子药物精准干预“癌变开关”的巨大潜力。虽然从实验室研究到临床应用还有一段路要走,但每一步的突破都凝聚着无数科研人员的心血,也承载着无数患者的期盼。MedFind将持续关注这类前沿进展,并为您提供最新的药物信息、诊疗指南以及海外购药渠道,帮助您在抗癌路上走得更稳、更有力。如果您对自身的病情或治疗方案有任何疑问,或希望了解更多关于特定靶向药物的信息,欢迎随时联系MedFind,我们的专业团队将竭诚为您服务。