乳腺癌是女性最常见的恶性肿瘤之一,其中有一类特殊的亚型,被称为“三阴性乳腺癌”(Triple-Negative Breast Cancer, TNBC)。这类癌症之所以被称为“三阴性”,是因为它的癌细胞上缺乏雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER2)这三种重要的靶点。正是因为缺乏这些靶点,TNBC的治疗方案非常有限,不能使用内分泌治疗,也不能直接使用HER2靶向药物。它恶性程度高、进展快、容易复发和转移,预后通常比较差,一直是乳腺癌治疗领域的一大难题。尤其是在TNBC中,如果HER2蛋白的表达水平非常低,甚至检测不到(即HER2-0表型),治疗选择就更是捉襟见肘,许多患者面临着无药可用的困境。
然而,医学的进步从未停止。近日,四川大学牛孟孟副研究员、肖智雄教授、米鹏教授、曹洋教授等研究人员带来了一项振奋人心的突破!他们发现了一种全新的治疗策略,有望让那些对现有HER2靶向药(如德曲妥珠单抗)几乎无响应的HER2-0三阴性乳腺癌患者重新获得治疗希望。这项研究为HER2-0实体瘤提供了新的治疗路径,并已在国际顶级科学期刊《Nature Cancer》上发表,再次证明了中国科研团队在抗癌领域做出的卓越贡献。MedFind作为专注于抗癌新药资讯和海外购药渠道的平台,将为您深度解读这项研究,希望能为焦急等待新疗法的患者和家属带来一线曙光。

三阴性乳腺癌:难治之殇与HER2-0的困境
乳腺癌根据其癌细胞表面的受体表达情况,可以分为几个主要类型。其中,HER2阳性乳腺癌、激素受体阳性乳腺癌,都有成熟的靶向药物或内分泌药物可以精准打击。然而,三阴性乳腺癌(TNBC)由于缺乏这三种常见的靶点(雌激素受体、孕激素受体和HER2),使得医生在治疗时很难找到“靶子”进行精确打击,主要依靠化疗。这意味着患者往往要承受化疗带来的巨大副作用,且肿瘤复发率和转移风险较高,预后相对较差。
近年来,抗体偶联药物(ADC)的出现,为HER2靶向治疗带来了革命性的变革。特别是德曲妥珠单抗(T-DXd),它被称为“武装的抗体”或“导弹化疗药”,能够精准识别癌细胞表面的HER2蛋白,然后将携带的剧毒化疗药物送入癌细胞内部,从而高效杀死癌细胞,同时最大限度地减少对正常细胞的损伤。德曲妥珠单抗已经在HER2阳性和HER2低表达的实体瘤治疗中展现出显著疗效,大大延长了患者的生存期。
然而,对于HER2-0表型的肿瘤,即使是强大的ADC药物德曲妥珠单抗也束手无策。因为这类肿瘤细胞表面的HER2蛋白水平极低,甚至检测不到,导致“ADC导弹”找不到足够的“靶子”进行结合,药物无法有效递送,治疗效果自然大打折扣。据统计,约60%的三阴性乳腺癌患者属于HER2-0表型,这使得他们对德曲妥珠单抗几乎没有响应。因此,如何让HER2-0肿瘤也能对这类高效的ADC药物敏感,一直是医学界亟待解决的难题。
科研新突破:发现FBXL2——HER2表达的关键“调节器”
为了打破HER2-0三阴性乳腺癌的治疗僵局,四川大学的研究团队深入探索了HER2蛋白在癌细胞内部的调控机制。他们进行了一系列细致的实验,最终锁定了一个名为E3泛素连接酶FBXL2的“幕后黑手”。这个FBXL2蛋白,就像细胞内部的“垃圾处理工”一样,负责标记和降解其他蛋白。研究发现,FBXL2是HER2蛋白的一个关键的“负向调控因子”,这意味着它的作用就是促进HER2蛋白的分解和清除。
具体来说,FBXL2通过一个叫做“泛素化”的生物学过程来完成这项任务。泛素化就像在HER2蛋白上贴上了一个“销毁标签”,一旦HER2蛋白被FBXL2贴上这个标签,它就会被细胞内的“蛋白酶体”这个“销毁机器”识别并迅速降解。因此,在HER2-0表型的三阴性乳腺癌细胞中,HER2蛋白之所以含量极低,正是因为FBXL2过于“勤奋”,把大部分HER2蛋白都给降解掉了。了解了这一关键机制,科学家们便有了一个大胆而创新的想法:如果能够抑制FBXL2的功能,阻止它降解HER2蛋白,那么HER2蛋白的水平是不是就能重新升高,从而让HER2-0肿瘤转化为HER2低表达,进而对德曲妥珠单抗敏感呢?
策略一:沉默FBXL2,唤醒HER2表达,让肿瘤“可见”
基于对FBXL2机制的理解,研究团队提出了第一个策略:通过沉默FBXL2来提升HER2的表达。他们利用一种叫做小干扰RNA(siRNA)的技术,来特异性地“关闭”FBXL2基因的表达。在细胞实验中,当siFBXL2成功沉默了HER2-0三阴性乳腺癌细胞中的FBXL2后,奇迹发生了:原本几乎检测不到的HER2蛋白,在细胞膜表面显著升高,使得这些HER2-0肿瘤细胞成功“转化”为HER2低表达状态。
更重要的是,这种转化并不是徒有其表。通过后续的药物敏感性测试,研究人员发现,这些经过siFBXL2处理的HER2-0肿瘤细胞,对德曲妥珠单抗的敏感性大幅提高,药物的半数抑制浓度(IC50)显著降低。这意味着,过去需要非常高剂量的德曲妥珠单抗才能产生效果,现在只需很低的剂量就能有效地抑制肿瘤细胞的生长。这一现象在多种HER2-0三阴性乳腺癌细胞系中都得到了验证,为后续的体内实验奠定了坚实的基础,也首次证实了“沉默FBXL2可以使HER2-0三阴性乳腺癌对德曲妥珠单抗敏感”的核心假设。
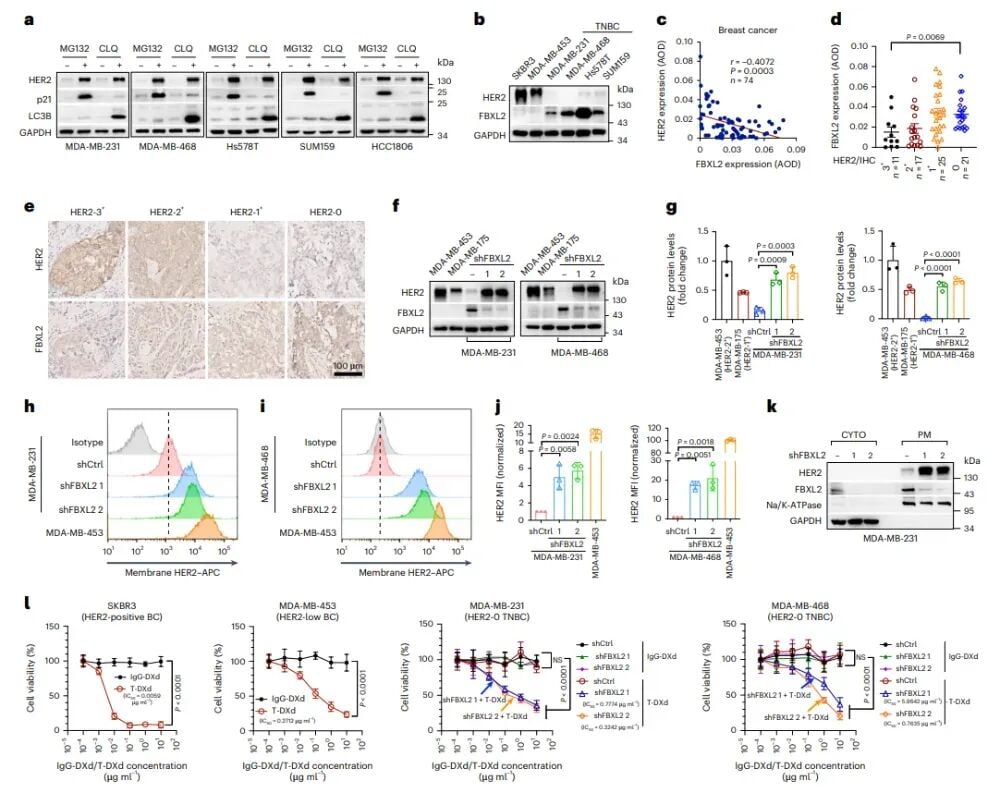
图1:沉默FBXL2可增加细胞膜上HER2的表达,并使HER2-0三阴性乳腺癌细胞对T-DXd敏感
精准递送的“抗癌快递”:脂质纳米颗粒(LNP)
虽然siRNA在细胞层面效果显著,但将其用于人体治疗面临巨大挑战。siRNA是一种小分子核酸,在体内极不稳定,容易被酶降解,而且很难高效、特异性地进入肿瘤细胞。为了解决这些问题,研究团队引入了先进的脂质纳米颗粒(LNP)递送系统。您可以把LNP想象成一个“微型智能快递车”,它能够将siRNA包裹起来,像保护珍贵货物一样,安全地送达目的地——肿瘤细胞。
研究人员精心构建了siFBXL2@LNP递送系统,并对其进行了全面评估。结果显示,这些LNP粒径均一,大小在70-80纳米之间,非常稳定。更重要的是,它们能够高效地被三阴性乳腺癌细胞摄取,并且巧妙地“逃脱”细胞内溶酶体的降解,成功地将siRNA释放到细胞质中发挥作用。在动物体内实验中,标记了荧光物质的siFBXL2@LNP在血液中循环时间更长,并且能特异性地富集在肿瘤组织,而对正常组织的影响很小。这意味着LNP能够将siFBXL2精准地送到肿瘤内部,有效降低肿瘤细胞中FBXL2的表达,并显著上调HER2水平。此外,在患者来源的类器官(PDO,一种模拟真实肿瘤的体外模型)中,siFBXL2@LNP与德曲妥珠单抗联合处理,也有效地抑制了肿瘤细胞的活力,为接下来的体内实验奠定了坚实的基础。
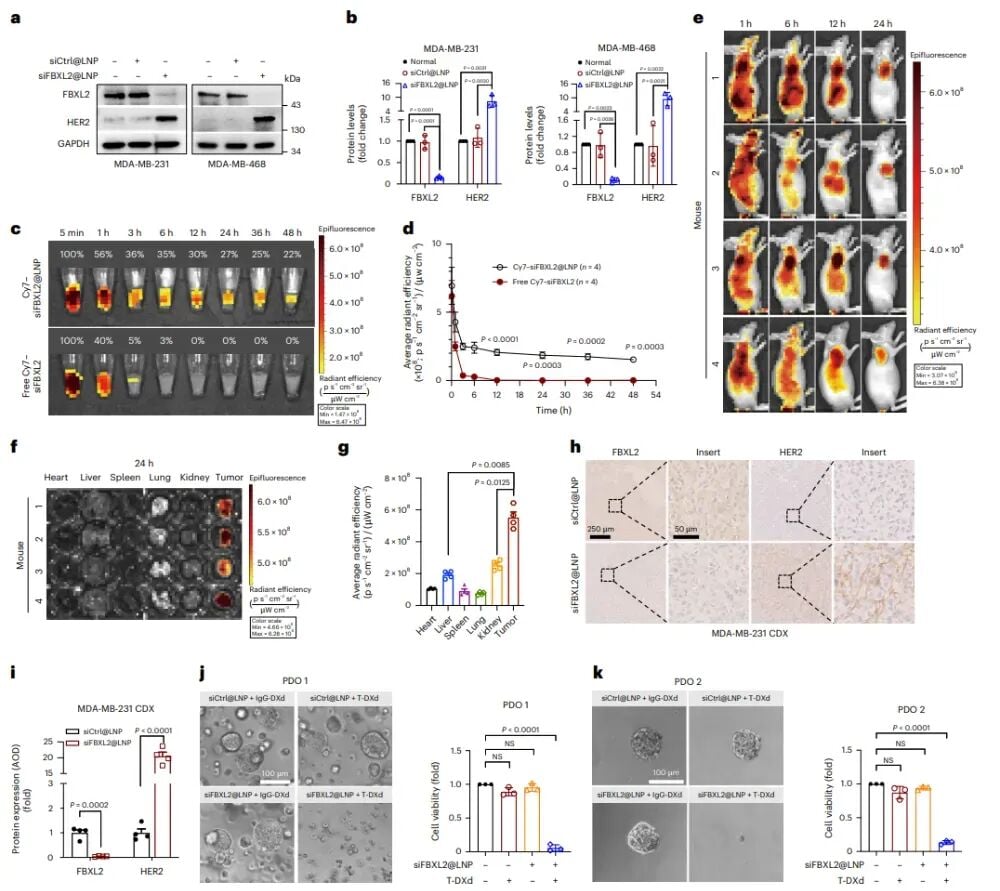
图2:构建用于向三阴性乳腺癌递送siFBXL2的脂质纳米颗粒(LNP)
联合出击:siFBXL2@LNP + 德曲妥珠单抗,强效持久抑制肿瘤
理论和体外实验的成功,最终需要在活体动物模型中进行验证。研究团队在多个小鼠模型中测试了siFBXL2@LNP与德曲妥珠单抗的联合治疗效果。首先,在MDA-MB-231细胞衍生的异种移植(CDX)模型中(即将人源肿瘤细胞移植到免疫缺陷小鼠体内),联合治疗组展现出惊人的效果:肿瘤显著消退,甚至达到了高达90%的完全缓解率(即10只小鼠中有9只肿瘤完全消失),并且小鼠的生存期大幅延长,没有出现肿瘤复发。这对于HER2-0三阴性乳腺癌来说,无疑是一个里程碑式的突破。
为了进一步验证这种疗法的临床转化潜力,研究人员还在患者来源的异种移植(PDX)模型中进行了验证。PDX模型是将真实的人类肿瘤组织直接移植到小鼠体内,它能最大程度地模拟患者体内肿瘤的生物学特性和药物反应。在这个更接近临床实际的模型中,siFBXL2@LNP与德曲妥珠单抗的联合疗法同样取得了显著成效,完全缓解率达到了83.3%。免疫组化分析显示,联合治疗组的肿瘤组织中,代表细胞增殖的Ki67标志物显著减少,而代表细胞凋亡(程序性死亡)的CC3和TUNEL标志物则明显增多,这直接证明了联合疗法能够有效抑制肿瘤细胞的增殖并诱导其大量死亡,从而实现肿瘤的强效消退。
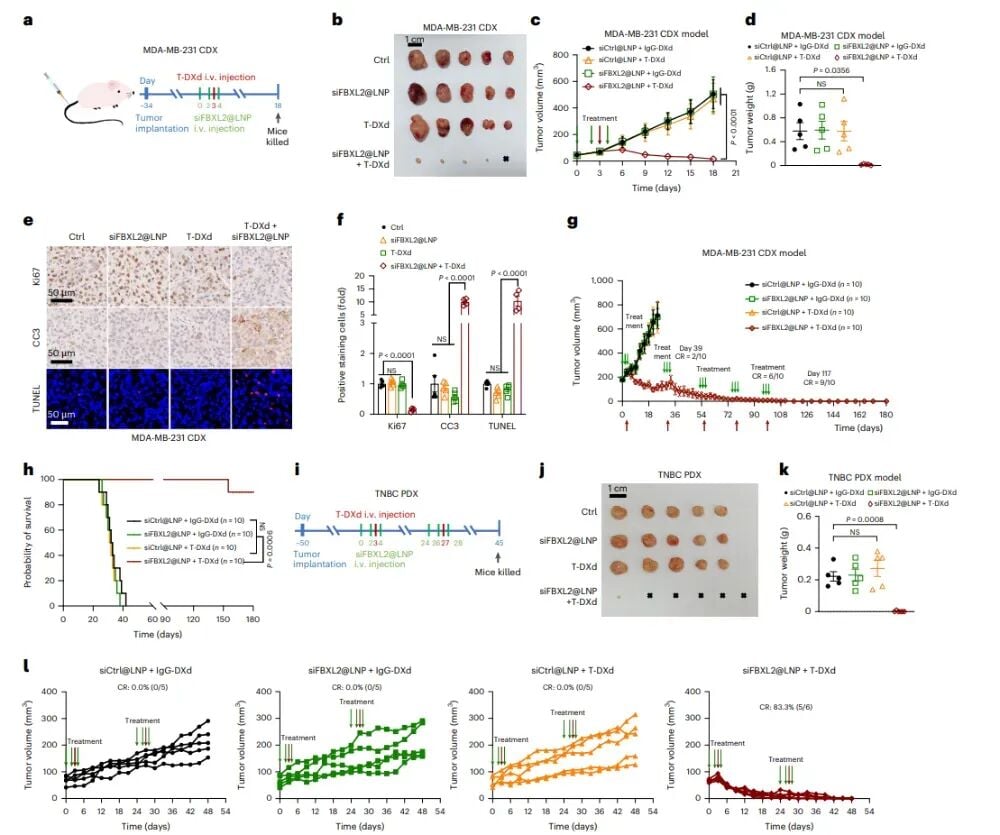
图3:siFBXL2@LNP与T-DXd联合治疗可显著抑制MDA-MB-231异种移植瘤及HER2-0三阴性乳腺癌患者来源异种移植(PDX)瘤的生长
FBXL2降解HER2的分子机制揭秘:精准锁定靶点
为了更深入地理解FBXL2如何调控HER2,为未来开发更精准的药物提供依据,研究团队进一步揭示了其分子机制。他们通过免疫共沉淀和泛素化实验等手段,证实了FBXL2确实是一种E3泛素连接酶,它能够与HER2、SKP1和Cullin1等蛋白形成一个复合体。在这个复合体中,FBXL2扮演着核心角色,它特异性地促进HER2蛋白在K48位点进行多聚泛素化修饰。正如前文所述,K48位的泛素化标签正是将HER2蛋白送往蛋白酶体进行降解的“死亡信号”。研究人员还通过构建缺失F-box结构域的FBXL2突变体(FBXL2ΔF),发现这种突变体会失去降解HER2的功能,进一步验证了F-box结构域在FBXL2介导HER2降解中的关键作用。这些详细的分子机制研究,不仅为FBXL2作为靶点提供了强有力的理论支撑,也为后续更小、更精细的靶向抑制剂的开发指明了方向。
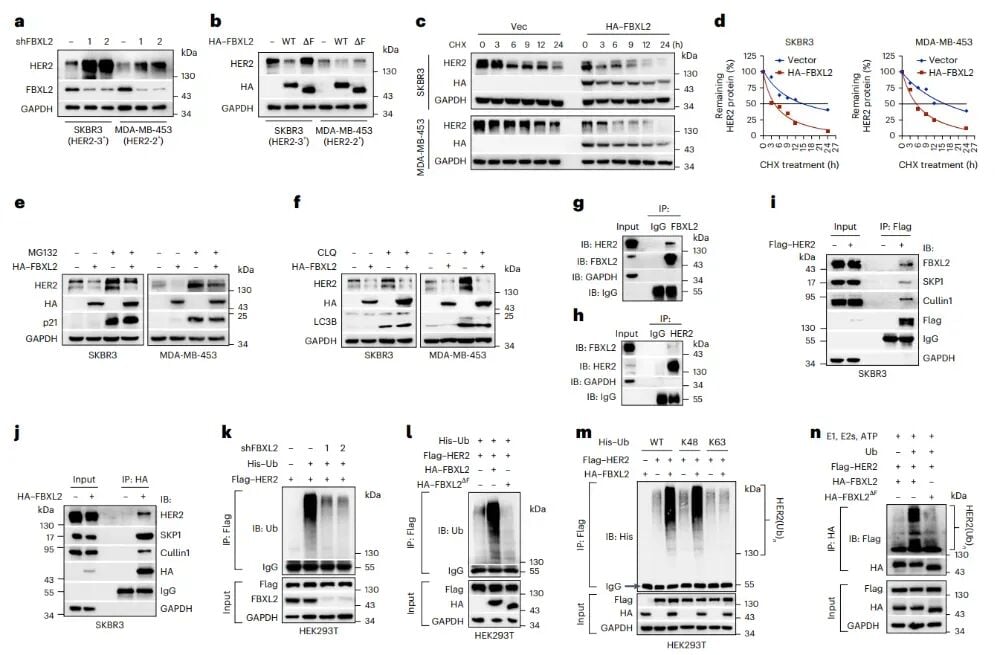
图4:FBXL2与HER2结合并促进其蛋白酶体降解
为了实现更精准的干预,研究团队进一步定位了FBXL2与HER2相互作用的“关键握手位点”。通过精密的结构域映射和点突变实验,他们发现FBXL2的9-13亮氨酸富集重复序列(LRR)域,以及HER2的激酶域,是两者结合的必需结构。更具体地,HER2蛋白上的R814位点被确定为与FBXL2结合的关键氨基酸,而K747位点则是FBXL2介导HER2泛素化修饰的核心位点。这意味着,如果能够设计出药物精确阻断这两个位点的相互作用,就可以有效阻止FBXL2对HER2的降解。这些发现为开发高度特异性的小分子抑制剂提供了精准的靶点信息,就像找到了控制一个复杂机器的关键开关一样。
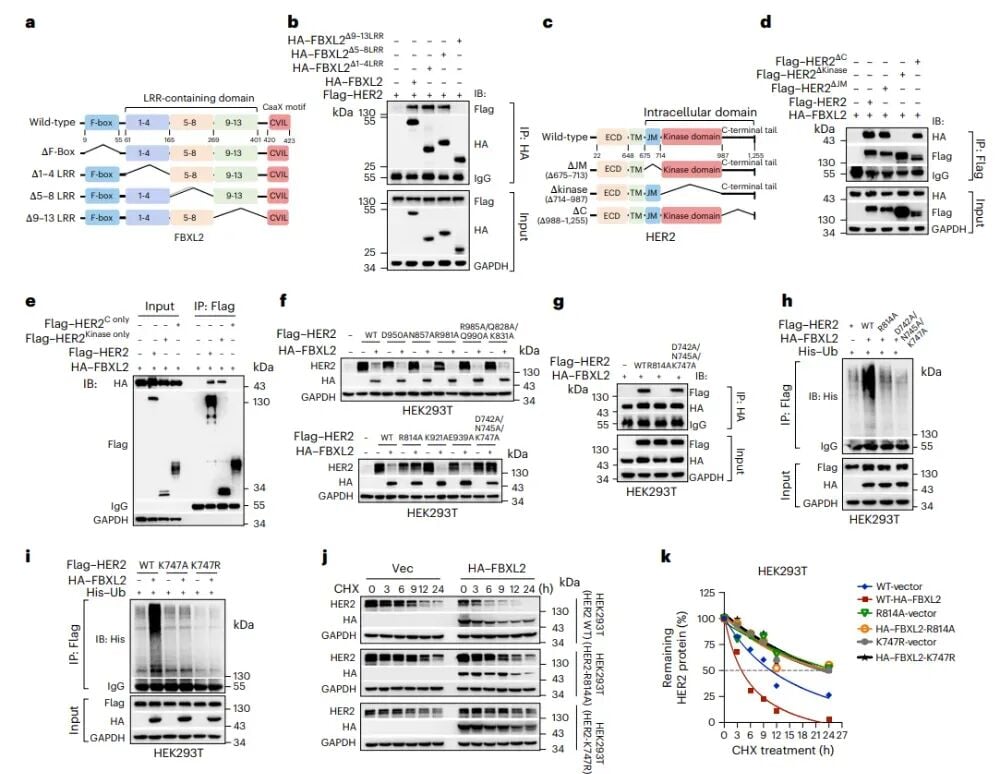
图5:FBXL2通过结合HER2的R814位点,促进HER2在K747位点的多聚泛素化
策略二:小分子抑制剂直击FBXL2——药物重用与快速转化潜力
除了通过siRNA直接沉默FBXL2基因,研究团队还探索了另一种更具临床转化潜力的方法:利用小分子药物来抑制FBXL2的功能。他们发现,FBXL2只有在细胞膜上定位才能有效地发挥其降解HER2的作用。因此,如果能够阻止FBXL2到达细胞膜,同样可以达到提升HER2表达的目的。
阻断FBXL2膜定位:GGTi-2418的新角色
研究人员发现,一种名为香叶基香叶基转移酶I(GGTaseI)的酶在FBXL2的膜定位中发挥着关键作用。因此,他们把目光投向了GGTaseI的抑制剂,其中GGTi-2418是一个重要的候选药物。实验结果表明,GGTi-2418处理后,HER2-0三阴性乳腺癌细胞中的HER2蛋白和ERBB2 mRNA(HER2基因的信使RNA)水平都呈现出剂量和时间依赖性的显著上调,再次将HER2-0细胞转化为HER2低表达状态。流式细胞术和集落形成实验进一步证实,GGTi-2418能显著提升细胞膜上的HER2表达,并增强细胞对德曲妥珠单抗的敏感性。这为开发一种口服或注射的小分子抑制剂来替代siRNA提供了新的方向,也意味着这种疗法在未来可能更易于临床应用。
在动物模型中,研究团队同样构建了GGTi-2418@LNP递送系统,并与德曲妥珠单抗联合使用。在PDO、CDX和PDX模型中,这种联合治疗均能显著抑制肿瘤生长,诱导强效消退。更令人欣喜的是,治疗过程中小鼠体重没有明显下降,组织也没有观察到明显损伤,显示出良好的安全性和耐受性,进一步证实了这种小分子联合疗法的有效性和安全性。
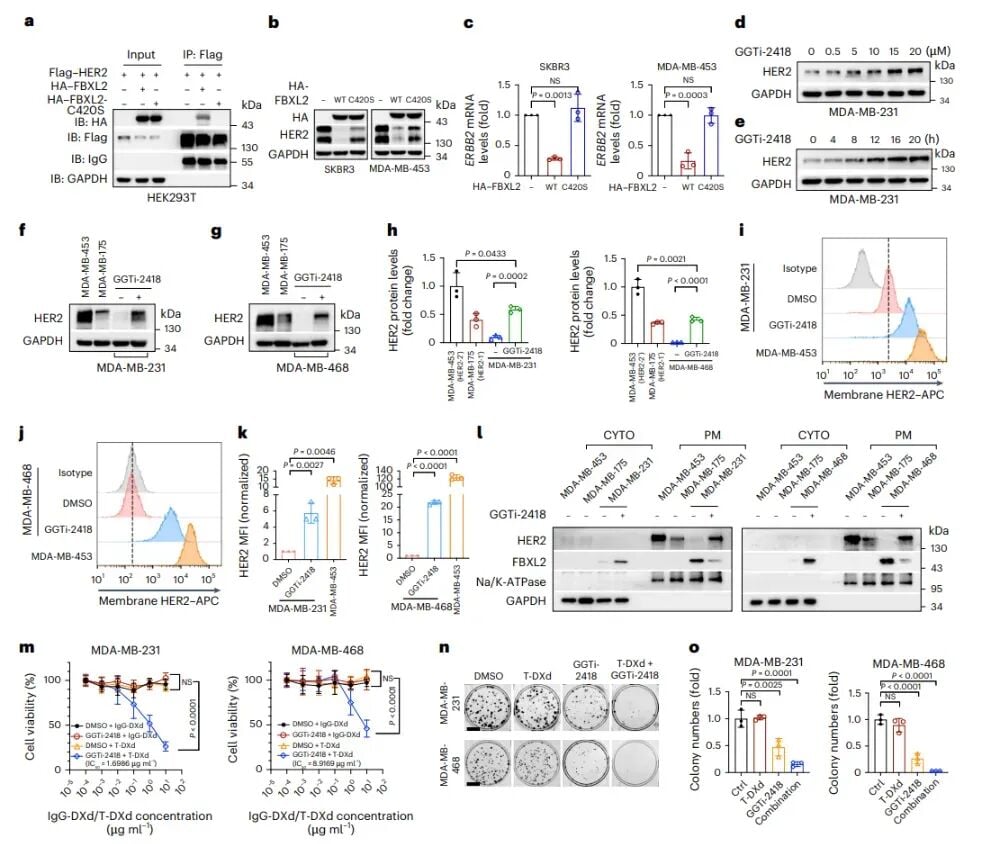
图6:膜定位缺陷型FBXL2(FBXL2-C420S)无法促进HER2降解,GGTi-2418通过抑制FBXL2膜定位使HER2-0三阴性乳腺癌细胞对T-DXd敏感
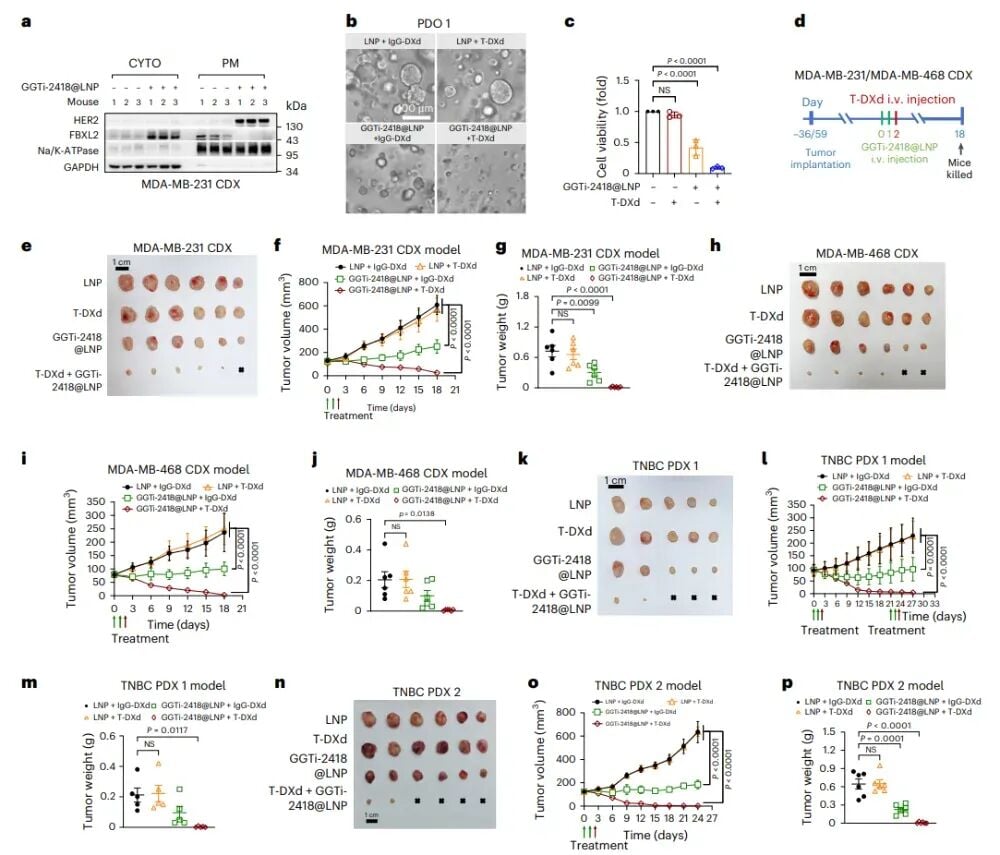
图7:GGTi-2418@LNP与T-DXd联合治疗可显著抑制HER2-0三阴性乳腺癌异种移植瘤的生长
老药新用:酮康唑(KCZ)的惊喜发现
在探索小分子抑制剂的过程中,研究团队还通过虚拟筛选FDA批准药物库,意外发现了一种“老药新用”的潜力——抗真菌药物酮康唑(KCZ)。令人惊喜的是,酮康唑同样能够抑制FBXL2的膜定位,从而间接阻止其降解HER2蛋白。实验证实,酮康唑也能以剂量依赖性方式上调HER2表达,成功将HER2-0三阴性乳腺癌细胞转化为HER2低表达。
进一步的体内实验显示,酮康唑@LNP与德曲妥珠单抗联合治疗,在CDX和PDX模型中均能诱导肿瘤显著消退。值得一提的是,酮康唑本身就具有多靶点抗癌活性,在单药使用时也能对肿瘤生长产生一定的抑制作用。更重要的是,安全性评估显示,酮康唑@LNP对小鼠的肝肾功能没有表现出明显的损伤。由于酮康唑是FDA已经批准上市的老药,其药代动力学和安全性数据已经相对完善,这使得这项联合疗法具有快速临床转化的巨大潜力,有望更快地惠及患者。
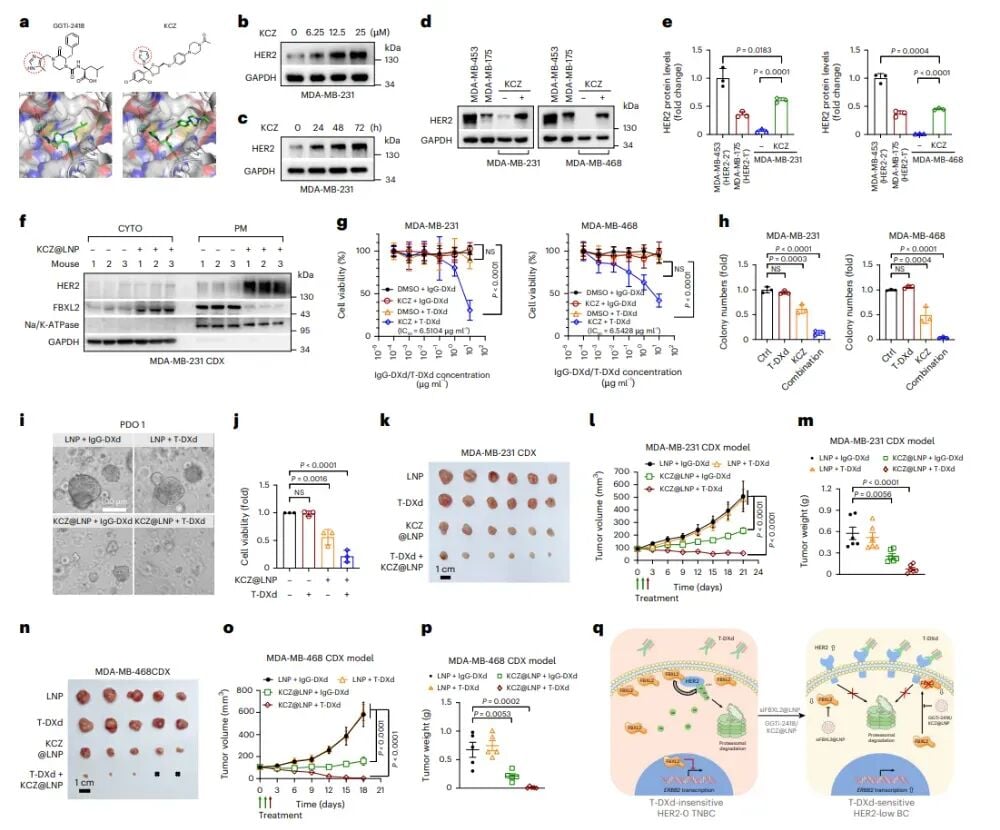
图8:KCZ@LNP可阻断FBXL2的膜定位,其与T-DXd联合治疗可显著抑制HER2-0三阴性乳腺癌异种移植瘤的生长
未来展望与MedFind的赋能
这项由四川大学研究团队带来的重大科研突破,完整地呈现了从“发现新靶点”到“阐明作用机制”,再到“开发新型递送系统”和“验证体内外疗效”的严谨科研逻辑。通过深入了解FBXL2在HER2蛋白降解中的关键作用,科学家们成功找到了让HER2-0三阴性乳腺癌“重见光明”的策略。无论是通过siRNA沉默FBXL2,还是利用GGTi-2418或老药酮康唑阻断其膜定位,都能有效上调HER2表达,将原本对德曲妥珠单抗无响应的肿瘤转化为敏感状态。结合先进的脂质纳米颗粒(LNP)靶向递送技术,这些疗法在动物模型中均展现出强效且持久的抑瘤效果,同时兼顾了良好的安全性。
这项研究不仅揭示了HER2表达调控的全新机制,更为HER2-0实体瘤患者(包括三阴性乳腺癌)提供了革命性的治疗新思路,有望让更多过去面临治疗困境的患者从德曲妥珠单抗等高效ADC药物中获益。尽管这些研究目前尚处于临床前阶段,但其所展现出的巨大潜力,无疑为无数患者和家属带来了新的希望。
MedFind平台始终致力于追踪全球最新的抗癌资讯和前沿疗法,为广大癌症患者及其家属提供专业、及时、通俗易懂的医学信息。我们深知患者对新药和新疗法的渴望,也将持续关注这类创新研究的临床转化进展。如果未来这项联合疗法能够成功进入临床试验并最终获批上市,MedFind将竭力为患者提供药物获取的咨询服务,包括但不限于国际直邮等渠道,确保患者能够及时、合法地获得这些可能改变生命的创新药物。
我们鼓励所有患者和家属,积极与您的主治医生沟通,了解最适合您病情的治疗方案。同时,也请您持续关注MedFind的更新,获取更多抗癌前沿信息,共同迎接医学进步带来的希望!