直肠腺癌遇上卵黄囊瘤:罕见病理的挑战与精准诊疗
当您或您的家人被诊断出癌症时,无疑会感到巨大的压力和迷茫。而如果被告知患上的是一种极为罕见的癌症类型,这种焦虑感可能会倍增。今天,我们将深入探讨一种特殊且罕见的肿瘤——伴有卵黄囊瘤样成分的直肠腺癌。这不仅是一种复杂的诊断,也对后续的治疗提出了更高的要求。通过一个真实的病例,MedFind希望帮助您理解这种罕见肿瘤的特点、诊断方法以及可能的治疗方向,让您在面对挑战时,能有更清晰的认知和更坚定的信心。
直肠腺癌:消化道常见的“不速之客”
直肠癌是结直肠癌的一种,在我国发病率较高,位居恶性肿瘤前列。它起源于直肠黏膜上皮细胞,通常表现为腺癌。常见的症状包括便血、排便习惯改变、腹痛等。对于大多数直肠腺癌患者而言,手术切除是主要的治疗手段,辅以化疗、放疗或靶向治疗,预后相对明确。
然而,医学的复杂性在于,总有一些“例外”情况。当直肠腺癌中混入了其他罕见的肿瘤成分时,情况就会变得异常复杂。本文将重点介绍的“卵黄囊瘤样成分”,就是其中一种极为罕见且具有挑战性的情况。
什么是卵黄囊瘤(YST)?为何会出现在直肠?
卵黄囊瘤的“前世今生”
卵黄囊瘤(Yolk Sac Tumor, YST),又称内胚窦瘤,是一种恶性生殖细胞肿瘤。顾名思义,它通常发生在性腺,如卵巢(占卵巢恶性肿瘤的3%-5%)和睾丸,多见于儿童和年轻女性。YST的特点是具有高度侵袭性,但对化疗敏感。在性腺以外的部位,YST也可能发生,通常好发于身体的中线位置,如纵隔、腹膜后和脑部。然而,在结肠和直肠发现YST,尤其是作为直肠腺癌的伴随成分,则极其罕见,目前全球文献报道的病例屈指可数。
直肠腺癌伴卵黄囊瘤样成分:罕见中的罕见
当直肠腺癌中出现“卵黄囊瘤样成分”时,意味着肿瘤组织中同时含有两种不同类型的癌细胞:一种是常见的腺癌细胞,另一种是具有卵黄囊瘤特征的细胞。这种混合性肿瘤被称为“结直肠卵黄囊瘤样癌”。本文报道的病例,正是目前文献记载的第7例此类罕见肿瘤,这足以说明其稀有性。
这种“混合”的机制目前尚不完全清楚,主要有两种假说:
- “碰撞瘤”假说:认为两种独立的肿瘤(腺癌和生殖细胞肿瘤)偶然在同一部位发生并共存。生殖细胞肿瘤可能起源于胚胎发育过程中“迷路”的生殖细胞。
- “去分化”假说:认为腺癌细胞在基因不稳定的情况下,发生了“返祖”现象,重新分化为具有生殖细胞特征的卵黄囊瘤样细胞。本病例中肿瘤位于非中线区域且与腺癌成分直接相邻,更倾向于支持“去分化”假说。
KRAS G12S突变与BRAF阴性:基因检测的重要性
在癌症治疗中,基因检测扮演着越来越重要的角色。对于结直肠癌而言,KRAS和BRAF基因是两个关键的生物标志物。
- KRAS基因突变:KRAS基因是细胞生长和增殖信号通路中的一个重要成员。当KRAS基因发生突变时,细胞会持续接收到生长信号,导致肿瘤失控性增殖。KRAS G12S突变是KRAS基因众多突变类型中的一种,它的存在通常预示着肿瘤对某些靶向药物(如EGFR抑制剂)可能不敏感,这会影响医生的治疗选择。
- BRAF基因阴性:BRAF基因也是细胞信号通路中的关键基因。BRAF突变在结直肠癌中相对少见,但一旦发生,通常预示着肿瘤恶性程度高,预后较差。本病例中BRAF基因突变为阴性,这至少排除了BRAF突变带来的额外不良预后因素。
因此,对于直肠腺癌患者,进行全面的基因检测(包括KRAS、BRAF等)至关重要。它能帮助医生更准确地评估肿瘤的生物学特性,指导后续的靶向治疗或化疗方案选择,实现真正的“精准医疗”。
真实病例解析:一位66岁患者的诊疗历程
为了让大家更直观地理解这种罕见肿瘤,我们来回顾一下本文报道的真实病例:
患者情况与初步诊断
一位66岁男性患者,因肛门出血入院。他有额颞叶痴呆病史,体力状况(PS)评分为2分,这意味着他日常生活活动能力受到一定限制。初步检查发现:
- 结肠镜检查:在距肛缘5厘米处发现一个25×20毫米的肿瘤。
- 活检结果:提示中分化管状腺癌,基因检测显示KRAS基因G12S突变阳性,BRAF基因突变阴性。
- 影像学检查(CT、PET-CT):显示直肠下段肠壁增厚,直肠上动脉及左侧髂内血管区域可见多发肿大淋巴结,但未发现远处转移。

▲摘自《WHO(2020)女性生殖系统肿瘤分类》
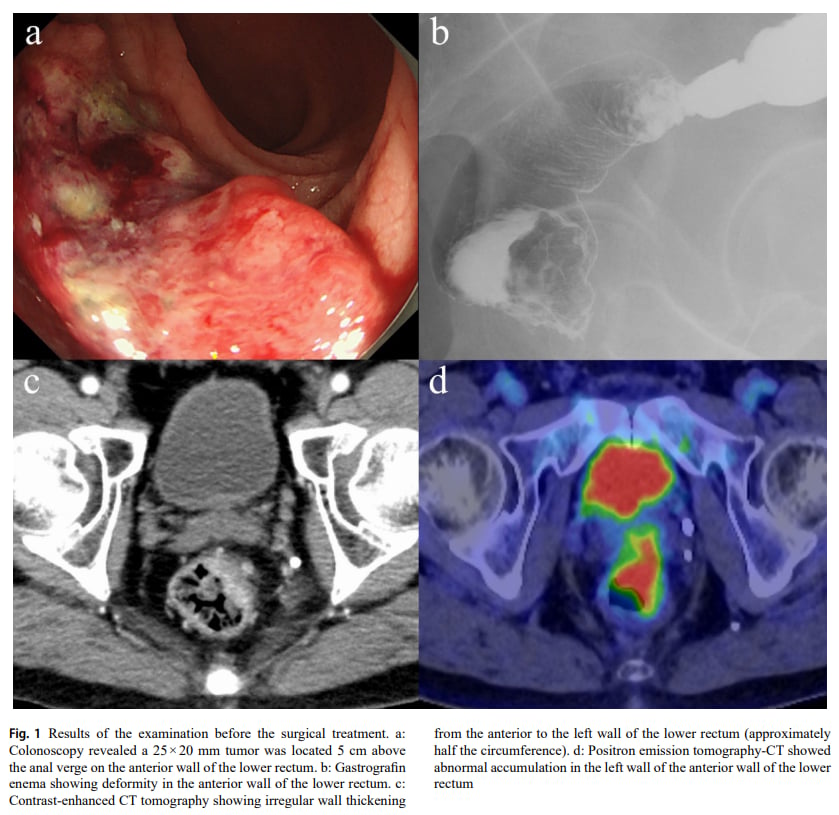
▲图1 术前检查结果
根据这些结果,医生诊断为低位直肠癌,临床分期为UICC第8版IIIC期(cT3cN2bM0),属于局部晚期。
手术与病理确诊
患者随后接受了腹腔镜腹会阴联合切除术,并进行了左侧淋巴结清扫。术中未发现腹膜或肝脏转移。手术切除的标本是最终确诊的关键:
- 组织病理学检查:除了典型的腺癌成分外,还发现了约5%的肿瘤组织具有卵黄囊瘤的特征,包括网状、管状及乳头状结构增生,甚至可见Schiller-Duval小体(YST的特征性结构)。
- 免疫组化染色:SALL4呈弥漫阳性,磷脂酰肌醇蛋白聚糖3(Glypican3)呈局灶阳性,而甲胎蛋白(AFP)呈阴性。这些结果进一步证实了卵黄囊瘤样成分的存在。
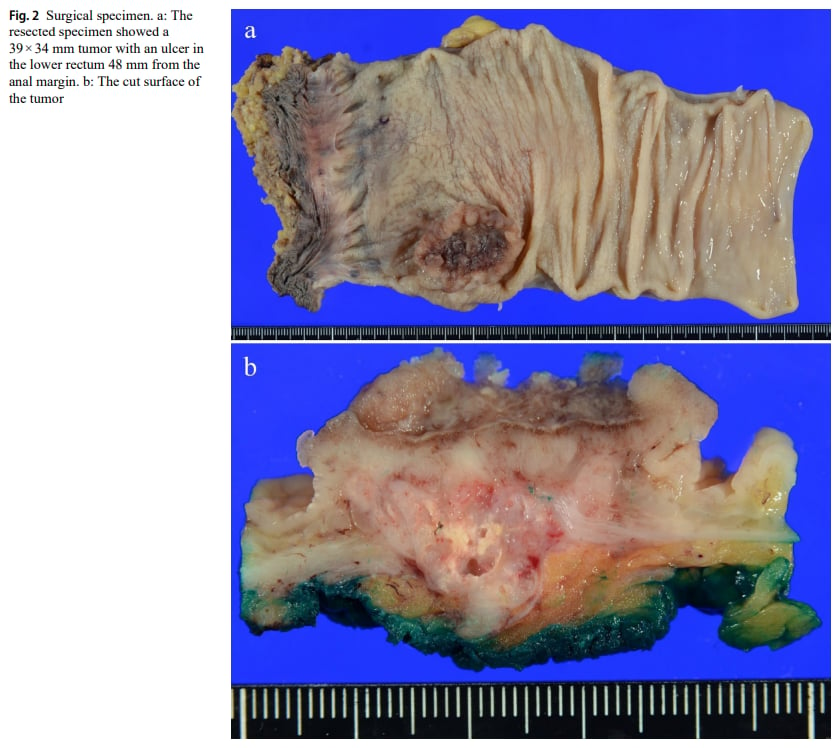
▲图2 手术标本
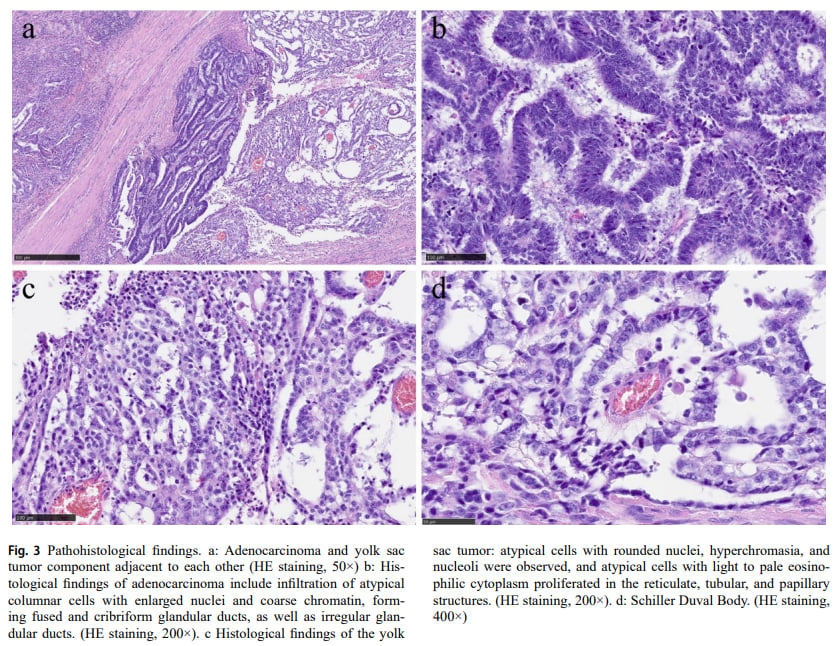
▲图3 病理组织学发现
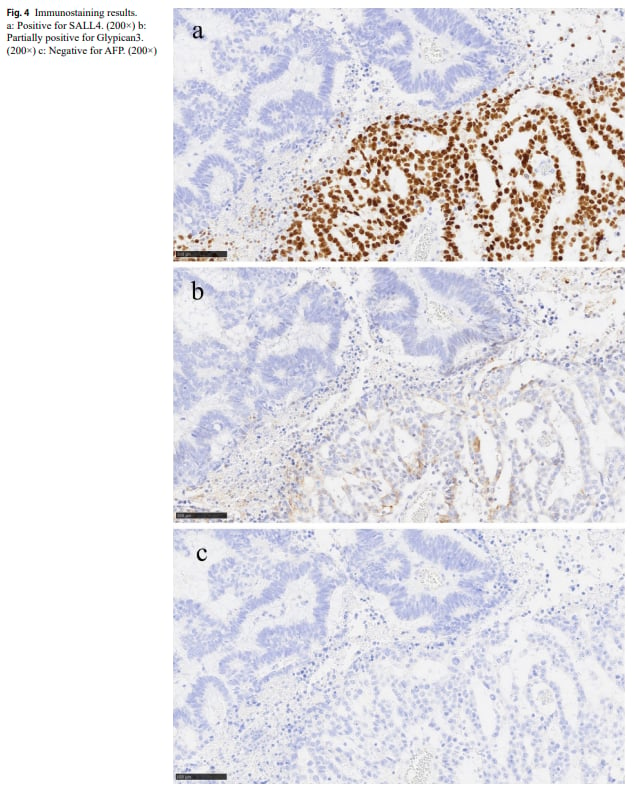
▲图4 免疫组化结果
最终诊断为伴卵黄囊瘤样成分的腺癌,病理分期为UICC第8版IIIB期(pT3pN2aM0)。
术后随访与肝转移
由于患者患有额颞叶痴呆,认知功能下降,且体力状况不佳,家属决定不进行术后辅助化疗,仅进行随访观察。然而,术后仅6个月,患者就出现了肝脏转移。遗憾的是,根据患者及其家属的意愿,最终决定不采取任何积极治疗措施。
诊断难点与关键线索:如何精准识别这类罕见肿瘤?
本病例的诊疗过程凸显了这类罕见肿瘤的诊断挑战。由于卵黄囊瘤样成分可能只占肿瘤的一小部分(本例中约5%),术前活检可能因取样局限而未能发现,导致漏诊。
病理学检查是“金标准”
要准确诊断直肠腺癌伴卵黄囊瘤样成分,详细的病理学检查至关重要。这包括:
- 组织形态学观察:寻找卵黄囊瘤特有的微囊型、网状型、腺管型、实体型结构,以及乳头型和肝细胞样型,特别是Schiller-Duval小体。
- 免疫组化染色:这是确认YST成分的关键。常用的标志物包括:
- SALL4:敏感性最高,几乎所有YST病例都呈阳性。
- Glypican3:敏感性也较高。
- AFP(甲胎蛋白):虽然卵巢YST病例的血清AFP水平几乎都呈阳性,但本病例的AFP免疫组化染色和术后血清AFP水平均为阴性。这提示我们,AFP阴性并不能完全排除YST样成分的存在,因为肿瘤内部AFP表达可能存在异质性,或肿瘤细胞本身不产生AFP。因此,需要结合多项指标综合判断。
与肠母细胞分化型结直肠腺癌(CAED)的鉴别
在诊断过程中,还需要将结直肠卵黄囊瘤样癌与另一种罕见的产AFP结直肠肿瘤——肠母细胞分化型结直肠腺癌(CAED)进行鉴别。CAED的核心特征是AFP合成增加,并表达肠母细胞标志物。尽管两者在临床特征上可能相似(如进展迅速、易发生肝转移、预后差),但通过详细的病理学检查(如细胞形态、免疫组化标志物表达谱)可以进行区分。
治疗困境与未来展望:个性化方案是关键
本病例的预后不佳(术后6个月出现肝转移),与其他结直肠卵黄囊瘤样癌的文献报道相似,提示这类肿瘤具有较高的恶性程度和较差的预后。
治疗方案的选择
对于典型的卵黄囊瘤(YST),标准治疗方案通常是4个周期的博来霉素+依托泊苷+顺铂(BEP)方案或异环磷酰胺+依托泊苷+顺铂(VIP)方案化疗,随后手术切除残留病灶。这些方案在性腺外YST的治疗中也显示出显著疗效。
然而,对于直肠腺癌伴卵黄囊瘤样成分的混合性肿瘤,治疗方案的选择变得复杂:
- 是优先针对腺癌成分进行治疗(如常规结直肠癌的化疗方案)?
- 还是优先针对卵黄囊瘤样成分进行治疗(如BEP/VIP方案)?
目前,由于病例极其罕见,尚无明确的标准化诊疗规范。本病例因患者自身情况(认知功能下降、体力状况差)未能接受术后辅助化疗,这无疑也影响了其预后。
MedFind的建议与展望
对于这类罕见且复杂的肿瘤,MedFind建议:
- 早期诊断是关键:若术前活检或术后组织学分析发现与常规直肠腺癌不同的表现,应高度警惕,并进行全面的免疫组化染色和基因检测。
- 多学科会诊:集合肿瘤内科、外科、病理科等多学科专家进行会诊,共同制定最合适的个性化治疗方案。
- 积极寻求新药和临床试验:对于KRAS G12S突变,目前已有针对性的靶向药物(如索托拉西布、阿达格拉西布)在临床试验中展现出潜力,但其在伴卵黄囊瘤样成分的直肠腺癌中的疗效尚待更多研究。
未来,需要积累更多此类罕见病例的数据,开展深入研究,以期建立标准化的诊疗规范,为患者带来更好的治疗效果。MedFind将持续关注全球最新的抗癌资讯和药物信息,致力于为患者提供最前沿的治疗选择和海外购药渠道。
MedFind能为您做什么?
面对罕见癌症的挑战,您不是一个人在战斗。MedFind作为由癌症患者家属发起的平台,深知您和家人所承受的焦虑与困惑。我们致力于:
- 提供权威资讯:分享最新的抗癌资讯和药物信息,帮助您了解疾病和治疗进展。
- AI辅助问诊:利用人工智能技术,为您提供初步的疾病解读和治疗方向参考。
- 海外购药渠道:如果您需要国内尚未上市的创新药物,MedFind可以协助您构建安全、可靠的海外购药与国际直邮渠道,让您及时获得所需药物。
如果您对直肠腺癌伴卵黄囊瘤样成分有任何疑问,或希望了解更多关于KRAS G12S突变相关治疗方案,请随时咨询MedFind。我们将以专业、温暖、客观的态度,为您提供支持和帮助。





