癌症治疗的困境:传统放化疗的毒副作用与靶向增效的需求
对于恶性肿瘤患者而言,放射治疗、化疗和手术是当前最主要的三大治疗手段。其中,化疗通过全身性给药杀伤快速分裂的癌细胞,但其固有的非选择性导致了严重的全身毒副作用,如骨髓抑制、胃肠道反应和脱发等,极大影响了患者的生活质量和治疗依从性。放射治疗虽然具有局部高剂量杀伤的优势,但对周围正常组织的损伤也限制了剂量的提升。
为了克服这些挑战,医学研究者们一直在探索如何将化疗药物的毒性精确地限制在肿瘤区域,实现“靶向激活”。近年来,一种新兴的联合治疗策略——辐射激活药物递送系统(Radiation-Activated Drug Delivery Systems, RADDS)——引起了广泛关注。它利用放射治疗产生的能量,在肿瘤局部精确地触发化疗药物的释放或激活,从而达到“双重打击”的效果:辐射杀伤肿瘤细胞的同时,激活的化疗药物进一步增强疗效,同时大幅降低药物在全身的暴露量。
荷兰代尔夫特理工大学Rienk Eelkema和Antonia G. Denkova团队在权威期刊《Nature Reviews Chemistry》上发表的综述文章,系统性地总结了这一前沿领域的化学基础、反应机制、应用进展与临床挑战,为癌症患者和家属理解未来治疗方向提供了重要的科学依据。如果您正在寻求更精准、毒副作用更小的癌症治疗方案,或希望了解前沿药物的海外购买渠道,本文将为您提供深度解读。
辐射激活药物递送(RADDS)的核心原理
辐射激活药物递送系统的核心在于利用离子辐射(如X射线、伽马射线或质子)与生物体内的水分子相互作用,产生高活性的化学物种,这些物种随后作为“信号”来激活处于休眠状态的前药(Prodrugs)。前药本身没有活性或活性很低,只有在特定条件下被激活后才能发挥化疗作用。
1. 什么是水辐解?—— 激活药物的“信号”来源
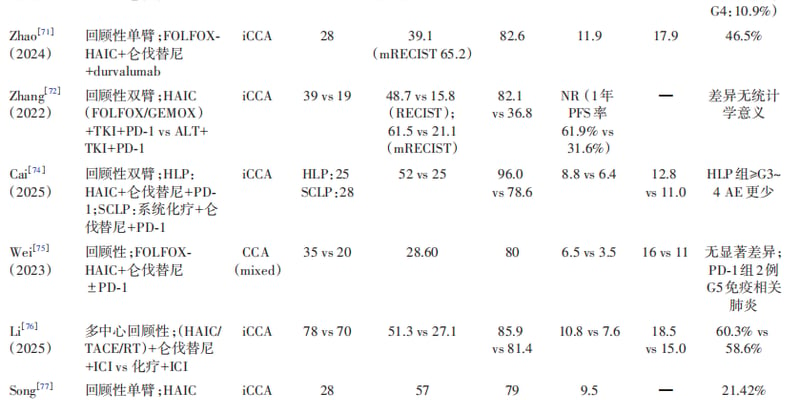
当离子辐射穿透人体组织时,由于人体大部分由水组成,辐射能量主要被水分子吸收。这一过程被称为“水辐解”。水辐解会瞬间产生多种高活性的化学物种,包括:
- 水合电子(eaq−):一种极强的还原剂。
- 羟基自由基(·OH):一种极强的氧化剂,反应活性极高。
- 氢自由基(·H)和过氧化氢(H₂O₂)等。
这些活性物种的生成、分布和寿命受辐射类型、剂量和线性能量转移(LET)等因素影响。理解这些物种的动力学过程,是设计高效辐射敏感前药的基础。原始文章指出,离子辐射与物质的相互作用主要依赖于原子组成而非分子结构,这意味着这种激活机制具有一定的普适性。

2. 关键的化学信使:水合电子的选择性优势
在设计辐射激活前药时,选择合适的激活物种至关重要。综述详细比较了水合电子和羟基自由基的反应活性:
- 羟基自由基(·OH):活性极高,几乎可以与所有有机分子发生反应,反应速率接近扩散控制。这意味着在复杂的生物环境中,·OH很容易被肿瘤细胞内的糖类、氨基酸等生物分子竞争性清除,导致其激活前药的选择性和效率较低。
- 水合电子(eaq−):虽然也是强活性物种,但它是一种强还原剂,对含硝基、卤素及缺电子体系具有更高的选择性。由于细胞内天然生物分子(如蛋白质、核酸)对水合电子的竞争性清除相对较弱,因此水合电子被认为是设计选择性辐射激活前药的更理想的化学信使。
通过建立反应竞争模型,研究人员量化了前药与细胞组分对这些活性物种的捕获效率。结论明确指出,利用水合电子的还原特性进行前药设计,能更有效地确保药物在辐射区域(即肿瘤内部)被精确激活。
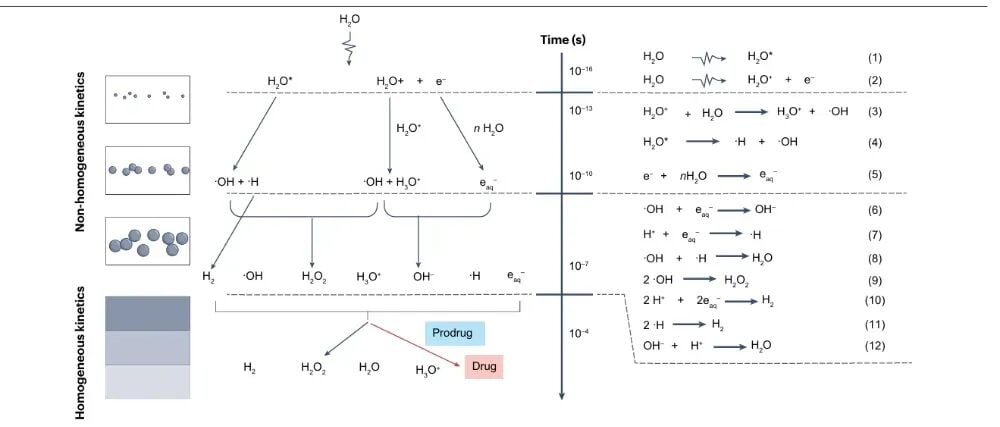
图1:水辐解的时间依赖性事件及相关反应。
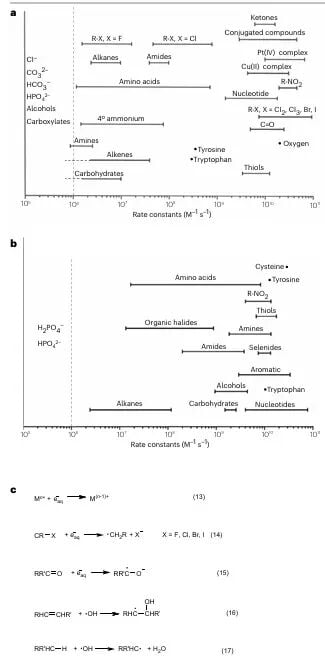
图2:水辐解生成的物种的反应活性。
辐射敏感前药的设计与激活机制
为了让前药能够响应辐射信号,化学家们需要将化疗药物与特定的“辐射敏感”官能团连接起来。综述总结了近年来基于不同官能团设计的辐射敏感前药系统,为未来的药物开发提供了丰富的思路。
1. 基于还原剂(水合电子)的激活策略
利用水合电子的强还原性,研究人员设计了多种可以被还原触发释放药物的分子结构:
- 羰基化合物和叠氮化合物:这些官能团在被水合电子还原后,会发生结构变化,从而释放出被包裹的活性化疗药物。
- N-氧化物和季铵盐:这些结构也对还原环境敏感,可以作为药物释放的触发器。
- 偶氮化合物:偶氮键(-N=N-)易被还原断裂,常用于药物载体或前药设计中。
- 金属配合物:在低氧环境下,辐射可以诱导金属离子还原为低价态,进而触发药物释放或激活。这种机制尤其适用于肿瘤内部常见的低氧微环境,实现了对肿瘤的进一步靶向。
这些设计旨在确保前药在没有辐射的正常组织中保持稳定,只有在肿瘤局部受到辐射时,才能高效、快速地释放出足量的活性药物,以克服细胞内清除剂的竞争。

图3:水合电子诱导的前药激活。
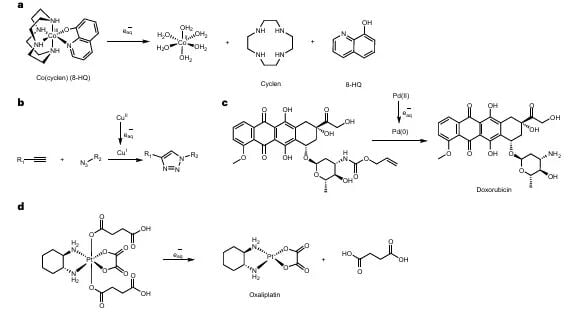
图4:低氧条件下辐射诱导金属离子还原为低价态。
2. 基于氧化剂(羟基自由基)的激活挑战
虽然羟基自由基(·OH)活性极高,理论上也能触发药物释放,但由于其在生物系统中的选择性差,容易被周围生物分子消耗,因此基于·OH的激活策略在临床转化中难度更高。不过,通过特定的纳米载体设计,例如利用纳米颗粒将前药与辐射敏感组分隔离,或采用“自牺牲型”释放策略,仍有可能提高激活效率。
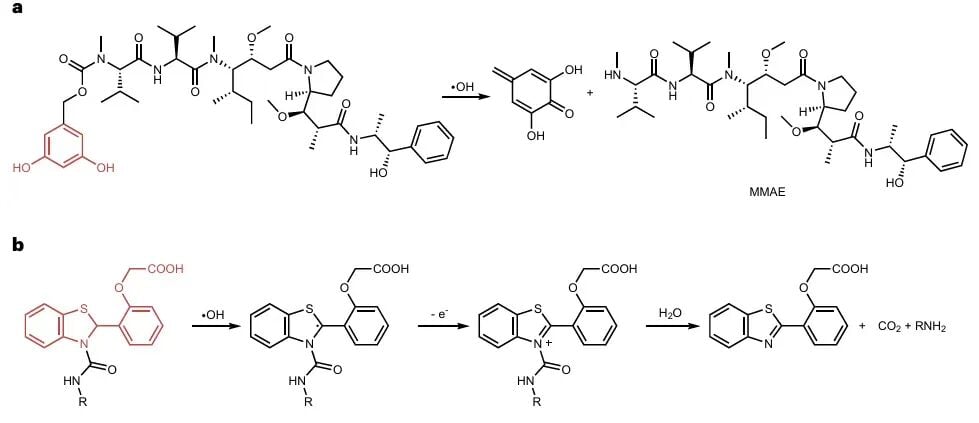
图5:·OH诱导的前药激活。
3. 药物递送载体的作用:实现靶向富集
除了前药本身的化学设计,将前药包裹在纳米载体(如胶束、脂质体)中是实现肿瘤富集和保护药物的关键步骤。辐射不仅可以激活前药,还可以诱导这些纳米载体解组装,加速药物的释放。这种载体设计有助于药物在肿瘤部位达到更高的浓度,进一步增强靶向性。
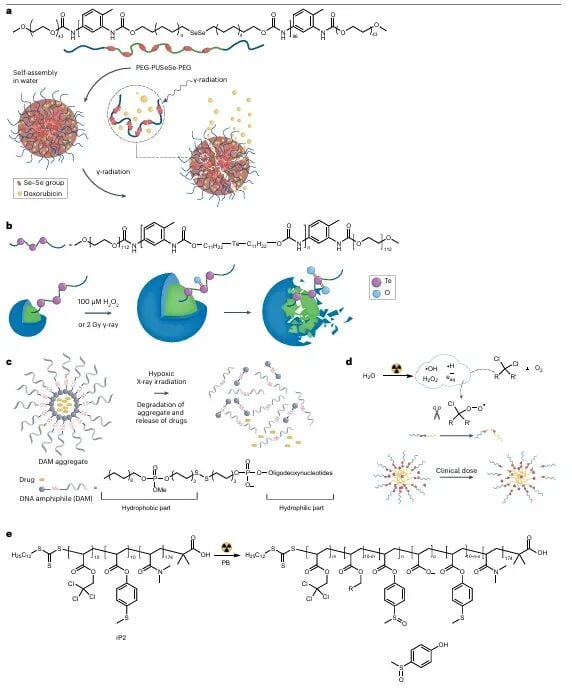
图6:辐射诱导胶束解组装。
4. 内源性激活:放射性核素的潜力
除了外部射线,放射性核素(如用于诊断或治疗的¹⁸F、⁹⁹ᵐTc、¹⁷⁷Lu等)也可以在体内通过水辐解产生活性物种,实现内源性药物激活。这种策略具有更强的靶向性,因为核素本身可以被设计成靶向肿瘤细胞的分子。将核素治疗(如PRRT)与辐射激活的化疗/免疫治疗相结合,有望实现更精准、更高效的癌症联合治疗。
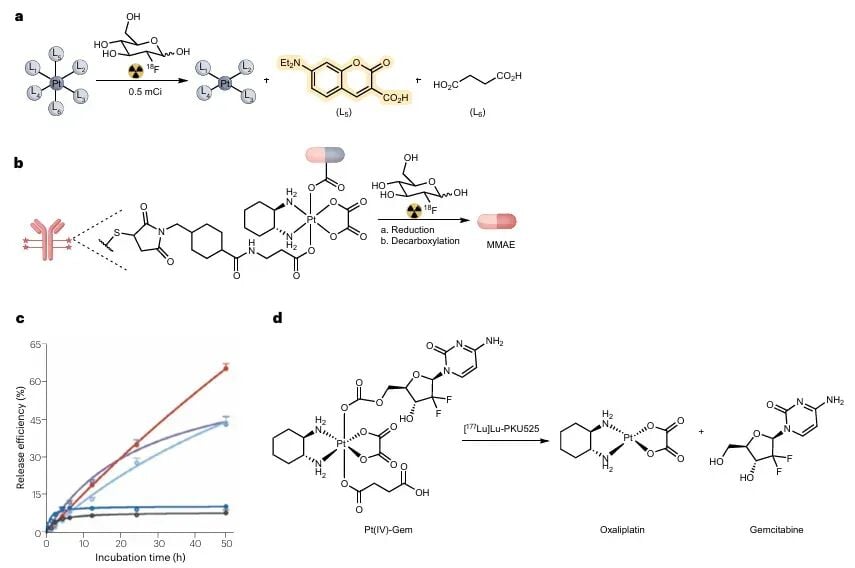
图7:放射性核素可传递辐射并诱导前药激活。
临床转化面临的挑战与未来展望
尽管辐射激活药物递送系统在理论上展现出巨大潜力,但从实验室走向临床应用仍面临多重实际挑战,这些挑战是患者和家属在关注此类前沿技术时需要了解的。
1. 辐射剂量的限制与激活效率
临床常规的放射治疗剂量通常在2–10 Gy(戈瑞)之间。在如此低的剂量下,水辐解产物(如水合电子)的产率相对较低。这意味着前药必须具备极高的辐射敏感性和反应性,才能在临床可接受的辐射剂量下实现高效激活和药物释放。如果激活效率不足,药物释放量可能无法达到有效的治疗浓度,或者容易被细胞内的解毒机制清除。
2. 前药的稳定性和生物竞争
一个理想的辐射激活前药必须满足两个相互矛盾的要求:
- 高稳定性:在没有辐射的正常组织中,前药必须保持高度稳定,不能提前释放活性药物,以确保全身毒性最小化。
- 高反应性:一旦受到辐射,前药必须能够迅速、高效地释放药物。
此外,在复杂的生物环境中,前药与细胞组分之间的竞争反应是不可避免的。如何设计出能够“战胜”生物竞争、确保药物在肿瘤局部快速释放的系统,是化学家们需要解决的关键问题。
3. 副产物的安全性
前药被激活释放药物后,其残余的化学结构(副产物)必须是无毒的,并且能够被身体安全地代谢和清除。任何具有潜在毒性的副产物都可能抵消靶向激活带来的益处。
4. 整合辐射化学与药物设计
未来研究需要进一步深化对辐射化学基础的理解,并将其与先进的药物设计理念相结合。例如,利用高活性药物(即使少量释放也能发挥强大作用)和自牺牲型释放策略(一旦触发,释放过程迅速完成),可能有助于应对低剂量、高竞争环境下的挑战。
综上所述,离子辐射触发药物释放为癌症治疗提供了一个革命性的新方向,有望显著降低传统化疗的全身毒性,并提高放化疗的协同疗效。虽然目前该技术仍处于临床前或早期临床研究阶段,但其发展速度预示着未来癌症患者将拥有更精准、更个性化的治疗选择。
获取前沿的癌症治疗信息与药物渠道
对于正在与癌症抗争的患者和家属来说,了解最新的治疗进展和药物信息至关重要。辐射激活药物递送系统代表了未来精准医学的方向,但目前临床上可及的靶向药和免疫疗法仍是主要的治疗选择。
MedFind(https://medfind.link)致力于为癌症患者提供最新的药物资讯、治疗方案解读以及全球范围内的药物获取服务。我们理解患者对前沿疗法和创新药物的渴望,并提供以下支持:
- AI辅助问诊服务:帮助患者理解复杂的医学报告和治疗方案,辅助决策。
- 药物信息解读:提供权威、易懂的药物机制、疗效数据和副作用分析。
- 国际药物获取:对于尚未在中国上市但已在海外获批的创新抗癌药物,我们提供国际直邮与代购服务,确保患者能够及时获取所需的救命药。
如果您对最新的癌症治疗方案(如靶向药、免疫疗法或联合治疗)有任何疑问,或需要咨询特定药物的海外用药选择与价格解析,欢迎随时联系我们,获取专业、可靠的帮助。

![[靶向NKG2D] 癌症治疗新突破!纳米导弹精准狙击肿瘤,让免疫逃逸无处遁形 9 [靶向NKG2D] 癌症治疗新突破!纳米导弹精准狙击肿瘤,让免疫逃逸无处遁形](https://medfind.link/wp-content/uploads/2026/02/e726e321a6e3ea1abbe5e2bdfdcf4f67.jpg)

![[老年癌症治疗] 营养不良竟是“隐形杀手”?最新研究揭示营养状况如何决定晚期患者的生活质量与心理寿命 11 [老年癌症治疗] 营养不良竟是“隐形杀手”?最新研究揭示营养状况如何决定晚期患者的生活质量与心理寿命](https://medfind.link/wp-content/uploads/2026/02/593fe2e79dc649c5a1d7d5270cd71c74.jpg)
![[乳腺癌放疗前沿] 2026 ACRO峰会解析:5次超短程放疗、ADC联合治疗及术前放疗新趋势 12 [乳腺癌放疗前沿] 2026 ACRO峰会解析:5次超短程放疗、ADC联合治疗及术前放疗新趋势](https://medfind.link/wp-content/uploads/2026/02/57d6336806df0675e1e56b17ffcad645.jpg)