引言:多线治疗失败的mCRC挑战与多基因检测的价值
转移性结直肠癌(mCRC)是全球范围内最常见且致命的癌症之一。对于经历过多线标准治疗后仍出现疾病进展的患者来说,治疗选择极为有限,预后往往不佳。在这种复杂且难治的临床情境下,传统的治疗模式难以奏效,迫切需要基于个体肿瘤分子特征的精准治疗策略。本文将深入分析一例携带复杂多基因突变(包括BRAF V600E、MET、NRAS、APC和TP53)的62岁男性mCRC患者的治疗历程,并重点解读国际分子肿瘤委员会(MTB)如何利用全面的基因组分析(包括组织NGS和循环肿瘤DNA,ctDNA)来制定高度定制化的联合治疗方案。
对于像本案例中这样多线治疗失败的患者,全面的分子谱分析是制定下一步治疗计划的关键。通过多基因检测,医生能够识别肿瘤的驱动基因、潜在的耐药机制以及可靶向的新靶点。这种信息驱动的个体化方法,旨在优化治疗效果,延长患者的生存期。对于面临国内治疗方案受限或药物可及性挑战的患者,了解国际前沿的治疗思路和海外用药选择,如通过国际直邮服务获取所需药物,是至关重要的。
复杂基因图谱解析:BRAF、MET、NRAS等突变的影响
本例患者的肿瘤基因组分析显示出高度的复杂性,同时存在BRAF、MET、APC、TP53和NRAS五种关键基因的突变。这些突变共同作用,导致肿瘤具有高度侵袭性、对标准治疗耐药,并持续进化。
BRAF V600E突变:侵袭性与靶向治疗的基石
在mCRC中,BRAF V600E突变是一个具有独特预后和治疗意义的亚型。它属于I类突变,能够激活MAPK信号通路,导致细胞不受控制地增殖。携带BRAF V600E突变的mCRC通常预后更差,对传统的化疗和抗EGFR单抗(如西妥昔单抗、帕尼单抗)的疗效较低。因此,靶向BRAF和/或其下游通路(如MEK)的联合治疗是这类患者的标准策略。
MET突变与扩增:潜在的耐药机制
MET受体酪氨酸激酶在突变或扩增时会激活MET信号通路,促进细胞增殖和转移。在本案例中,患者在疾病进展过程中,MET的拷贝数从3.2急剧增加到10.1。这种显著的MET扩增是肿瘤逃避既往BRAF抑制剂治疗后出现耐药的重要机制之一。因此,靶向MET成为后续治疗中必须考虑的关键靶点。
NRAS、APC和TP53突变的角色
- NRAS突变:NRAS是RAS癌基因家族的成员,其突变会导致MAPK通路的持续激活。NRAS突变的存在,即使丰度较低,也可能独立于EGFR激活下游信号通路,从而导致肿瘤对帕尼单抗等抗EGFR治疗产生耐药。
- APC突变:APC突变在mCRC中极为常见(约80%的病例),是肿瘤发生和进展的关键驱动因素,主要通过导致WNT信号通路的不受控制激活。
- TP53突变:TP53是关键的抑癌基因,其功能丧失与更具侵袭性的肿瘤特征相关,并且TP53突变会上调VEGF/VEGFR轴,促进血管生成,这也是MTB建议使用VEGFR抑制剂(如瑞戈非尼)的理论基础之一。
难治性mCRC的治疗历程回顾(五线治疗分析)
该患者在确诊IV期mCRC后,经历了五线治疗,每次治疗初期虽有应答,但随后均快速进展,充分体现了其肿瘤的侵袭性和复杂性。
一线至三线治疗:化疗与早期试验
患者的治疗目标最初是促进肝转移灶的切除:
- 一线治疗:接受FOLFOX方案(奥沙利铂、亚叶酸、氟尿嘧啶)围手术期化疗,PFS持续10个月。
- 二线治疗:因复发接受FOLFIRI方案(伊立替康、亚叶酸、氟尿嘧啶),但不到两个月即因疾病进展而终止。
- 三线治疗:入组一项涉及外排泵抑制剂的早期临床试验,但很快进展。
在此阶段,定制基因panel检测证实了BRAF V600E突变,并检测到TMB为11.19 muts/Mb,属于非高TMB,提示免疫治疗获益的可能性较低。
四线治疗:达拉非尼联合帕尼单抗的挑战与耐药机制
2023年2月,患者接受了达拉非尼(BRAF抑制剂)联合帕尼单抗(EGFR抗体)的同情用药治疗,最初获得部分缓解。然而,五个月后疾病再次进展。
关键的ctDNA监测揭示了耐药机制的演变:
- 在缓解期(2023年5月),BRAF变异丰度(VAF)为2.09%。
- 在疾病进展时(2023年8月),BRAF VAF急剧升高至41.58%,同时检测到低丰度的NRAS Q61K突变(0.38%)。
这表明肿瘤克隆在治疗压力下迅速进化,BRAF突变克隆重新占据主导地位,同时新出现的NRAS突变可能进一步削弱了抗EGFR药物帕尼单抗的疗效。
五线治疗:新型BRAF抑制剂的失败与MET扩增
患者随后接受了一种新型BRAF V600抑制剂的I期临床试验。虽然初期达到疾病稳定,但两个月后再次进展。此时的分子检测显示:
- BRAF VAF仍高(20.93%)。
- MET拷贝数从3.2增加到10.1,提示MET信号通路被激活,成为主要的逃逸机制。
患者在整个治疗过程中一直保持良好的ECOG体能状态(0分),但在MTB讨论后接受瑞戈非尼治疗,最终因疾病进展和体能状态恶化而去世。
国际MTB定制化联合治疗方案深度解读
面对患者复杂的基因图谱和多线治疗失败的困境,WIN国际分子肿瘤委员会(MTB)提出了多种高度定制化的联合治疗方案,旨在同时阻断多个关键信号通路,限制肿瘤的逃逸机制。
方案一:埃万妥单抗+曲美替尼+瑞戈非尼的联合逻辑
这是MTB提出的首选定制方案,其核心在于多靶点协同作用:
- 埃万妥单抗(Amivantamab):这是一种抗MET/EGFR双特异性抗体。考虑到患者既往对抗EGFR抗体有应答,且存在显著的MET扩增,该药能够同时阻断这两个关键通路。MTB建议使用标准剂量的1/3。
- 曲美替尼(Trametinib):作为MEK抑制剂,它用于针对BRAF V600E突变激活的MAPK通路。联合使用BRAF抑制剂(如达拉非尼)和MEK抑制剂(如曲美替尼)是BRAF突变mCRC的经典策略,但在此方案中,MTB选择MEK抑制剂作为联合方案的一部分。
- 瑞戈非尼(Regorafenib):这是一种多靶点酪氨酸激酶抑制剂,具有VEGFR抑制活性。MTB认为,瑞戈非尼可能通过其WNT抑制剂活性来针对APC突变,并通过VEGFR抑制活性来针对TP53突变上调的VEGF/VEGFR轴。
该方案试图同时解决BRAF、MET、EGFR、APC/WNT和TP53/VEGF等多个驱动因素,体现了“定制化”和“多重阻断”的理念。
方案二:曲美替尼+西妥昔单抗+卡博替尼
第二个方案同样是多靶点联合:
- 曲美替尼(MEK抑制剂):继续针对BRAF V600E突变。
- 西妥昔单抗(EGFR抗体):针对EGFR通路。
- 卡博替尼(Cabozantinib):这是一种强效的MET和VEGFR抑制剂。鉴于患者的MET扩增和TP53突变(上调VEGF),卡博替尼能够有效地阻断这两个关键的逃逸和转移通路。
MTB专家强调,这种定制联合治疗方法涉及超说明书用药,且药物可及性在不同国家存在差异。对于需要获取这些国际前沿药物的患者,了解可靠的海外用药渠道和AI辅助问诊服务,可以帮助患者及其家属更好地评估治疗方案和药物获取的路径。
其他潜在方案:克唑替尼、ADC与局部治疗
MTB还讨论了其他几种可能性:
- 克唑替尼(Crizotinib):这是一种靶向MET和ALK的抑制剂。MTB讨论了将克唑替尼与其他药物(如瑞戈非尼或达拉非尼)联合使用的可能性,以优先聚焦于靶向显著扩增的MET。
- 抗癌胚抗原(anti-CEA)ADC:如果患者是CEA分泌者,靶向CEA的抗体-药物偶联物(ADC,以拓扑替康为载荷)可能是一种有益的替代方向,尤其是在靶向治疗进展后。
- 局部治疗:MTB提醒,评估肝动脉灌注(HAI)或姑息性放疗等局部治疗的使用是否会影响患者未来临床试验的入选资格,这一点至关重要。
尽管MTB提供了详尽的建议,但最终的治疗决策仍由主治医生根据当地的药物可及性、医保政策和患者具体情况决定。
个体化精准治疗的科学依据与临床证据
本案例强调了在难治性mCRC中,匹配治疗(Matching Therapy)的重要性。这种方法通过将治疗方案与患者肿瘤的特定分子改变相匹配,在改善临床结局方面显示出显著益处。
I-PREDICT和WINTHER研究的启示
两项里程碑式的临床研究为个体化精准治疗提供了关键证据:
- I-PREDICT试验:这项前瞻性试验表明,接受与肿瘤分子改变匹配的治疗的患者,临床结局得到改善,包括更高的缓解率和更长的生存期。匹配程度更高的个体化治疗,其无进展生存期(PFS)显著优于匹配改变较少的患者。
- WINTHER试验:该试验利用基因组和转录组数据指导个性化治疗,进一步证明了在晚期癌症患者中实施匹配治疗和改善临床结局的可行性。
这些研究共同支持了MTB的定制化联合治疗策略,即在多线治疗失败后,只有通过精准匹配和多重阻断,才有可能获得有意义的临床获益。
后线治疗的困境与瑞戈非尼/TAS-102的数据
随着mCRC患者接受的治疗线数增加,获得有意义肿瘤缓解的概率显著下降。MTB的讨论也引用了后线治疗的经典数据,以强调新策略的必要性:
- RECOURSE试验(TAS-102):评估三氟尿苷/tipiracil(TAS-102)在既往接受过至少两种化疗方案的mCRC患者中的疗效。结果显示,TAS-102组的中位OS为7.1个月,中位PFS为2.0个月。
- CORRECT试验(瑞戈非尼):评估瑞戈非尼在标准治疗进展后的mCRC患者中的疗效。瑞戈非尼组的中位OS为6.4个月,中位PFS为1.9个月。
这些数据表明,在难治性mCRC的后线治疗中,中位PFS通常不足两个月。这进一步突显了本案例中MTB提出的定制联合方案的价值——它们是突破传统后线治疗瓶颈的尝试。
关于瑞戈非尼的使用,MTB讨论了从低剂量(40 mg)开始,若耐受则递增至80 mg的策略,这与ReDOS研究的发现一致,即剂量递增策略可以提高患者的耐受性和依从性,从而可能改善疗效。
分子监测与肿瘤进化的核心作用
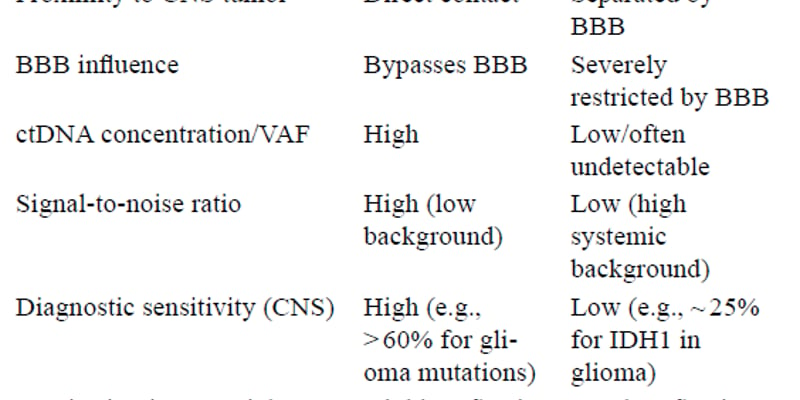
本案例的另一个核心启示是重复进行分子检测,特别是循环肿瘤DNA(ctDNA)和组织下一代测序(NGS),对于指导治疗决策至关重要。
ctDNA的实时监测价值
ctDNA分析提供了一种实时、非侵入性的方法来监测肿瘤的动态变化。在本案例中,ctDNA成功捕捉到了BRAF VAF的急剧升高和NRAS Q61K突变的出现,这些都是导致达拉非尼联合帕尼单抗治疗失败的关键耐药机制。此外,后期的液体活检还检测到MET拷贝数的显著增加。
通过追踪这些变异丰度(VAF)的变化,医生能够及时了解肿瘤的进化方向,并在疾病进展前预判耐药机制,从而更早地调整治疗方案。
组织NGS与ctDNA的结合
虽然ctDNA提供了实时动态信息,但组织NGS能够提供更全面的基因组图谱。两者结合使用,可以提高可靶向目标的检测率,并帮助区分低丰度变异(如本案例中低丰度的NRAS Q61K)是真正的肿瘤突变还是意义未明的克隆性造血(CHIP)。MTB专家指出,如果可行,组织活检对于确认NRAS突变的性质至关重要。
结论与展望:多基因检测在难治性癌症中的核心作用
本例复杂的转移性结直肠癌患者的治疗历程,清晰地展示了多基因检测和国际多学科团队(MTB)讨论在管理难治性癌症中的核心作用。面对BRAF V600E、MET扩增、NRAS等多种驱动因素和耐药机制并存的复杂局面,传统的单药或标准联合治疗难以持续获益。
通过定制化的联合靶向治疗策略,同时阻断多个关键通路(如BRAF/MEK、MET/EGFR、WNT/VEGFR),是突破后线治疗瓶颈的关键方向。I-PREDICT和WINTHER等研究已证实,这种基于分子匹配的治疗方法能够显著改善临床结局。
对于国内患者而言,了解这些国际前沿的治疗方案,并探索包括海外新药信息与获取渠道在内的多种选择,是争取更长生存期的重要途径。持续的分子监测,特别是ctDNA的动态追踪,将继续在指导难治性癌症的个体化治疗中发挥不可替代的作用。

▲图1 突出显示了来自世界各地的18个参与机构,MTB中讨论的患者来自西班牙

▲表1 分子变异

▲图2 治疗时间线