导语:EGFR突变肺癌治疗的十字路口与新希望
2025年,全球肿瘤学界的目光再次聚焦于芝加哥,美国临床肿瘤学会(ASCO)年会如期而至。对于无数表皮生长因子受体(EGFR)突变型非小细胞肺癌(NSCLC)患者而言,这次盛会不仅是学术交流的殿堂,更是希望的灯塔。在过去十年,以奥希替尼(Osimertinib)为代表的第三代EGFR-TKI(酪氨酸激酶抑制剂)彻底改变了晚期EGFR突变肺癌的治疗格局,极大地延长了患者的生存期。然而,耐药性的出现,如同一道难以逾越的屏障,始终是悬在患者与医生心头的利剑。当奥希替尼耐药后,我们该何去何从?
本届ASCO年会公布的一系列重磅研究,为我们揭示了未来的方向。从突破耐药瓶颈的联合治疗新策略,到早期患者术后辅助治疗的长期获益;从针对年轻患者、合并特殊疾病患者的个体化探索,到对耐药机制更深层次的剖析,EGFR突变肺癌的治疗正迈向一个更加精准、多元和充满希望的新纪元。本文将为您深度解读2025 ASCO年会的关键进展,希望能为您的抗癌之路提供有价值的参考与支持。
一、 EGFR靶向治疗再进化:从单一抑制到协同作战
面对耐药这一核心挑战,单一的靶向治疗已略显乏力。本届ASCO大会的研究成果清晰地指向一个趋势:联合治疗是未来的主流。通过不同机制药物的协同作用,我们有望延缓耐药、深化疗效,为患者争取更长的生存时间。
1.1 奥希替尼耐药后,联合治疗带来新曙光
当患者对奥希替尼产生耐药后,后续治疗选择极为有限。为此,研究者们正积极探索“奥希替尼+X”的联合模式。
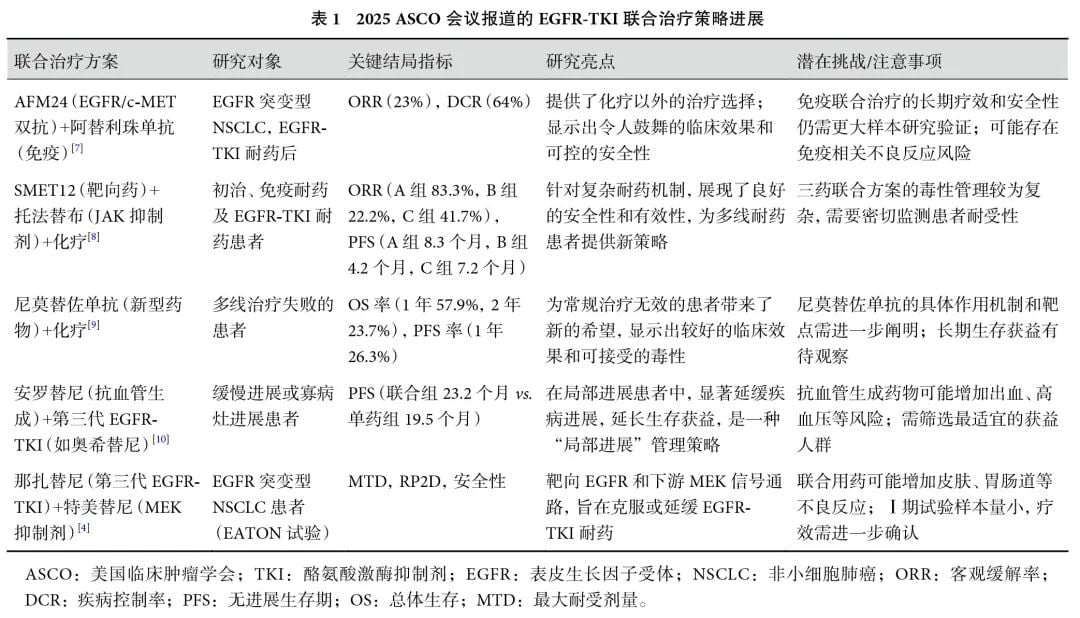
- 靶向通路联合:EATON试验探索了第三代EGFR抑制剂那扎替尼与MEK抑制剂特美替尼的联合方案。尽管初步疗效有限,但该研究成功验证了此联合方案的安全性,并为后续通过生物标志物筛选优势人群奠定了基础。
- 联合新型ADC药物:备受瞩目的TROPION-Lung14研究,是全球首个评估奥希替尼联合新型TROP2靶向抗体药物偶联物(ADC)Dato-DXd用于一线治疗的Ⅲ期临床试验。ADC药物如同“生物导弹”,能精准地将高效化疗药带到肿瘤细胞内部,实现精准杀伤。这项研究的结果将可能重新定义EGFR突变肺癌的一线治疗标准。
此外,将EGFR-TKI融入围手术期治疗也取得了重大突破。研究数据显示,术前新辅助靶向治疗能显著缩小肿瘤,提高手术完全切除率(R0切除率高达90%以上),并大幅降低术后复发风险,为早期患者的治愈带来了更大可能。
1.2 早期肺癌辅助治疗:长期获益得以证实
对于可手术的早期EGFR突变肺癌患者,术后复发是最大的担忧。CORIN研究的长期随访数据为我们带来了定心丸。该研究证实,对于完全切除的IB期EGFR突变患者,术后接受一年的辅助埃克替尼治疗,其5年无疾病生存(DFS)率高达88.5%,远超观察组的67.7%。这表明,辅助靶向治疗能够持续、有效地抑制微小残留病灶,显著降低复发风险。
1.3 应对复杂共存突变:双靶联合精准打击
约有三到五成的EGFR突变患者同时携带TP53、PI3KCA等共存突变,这类患者往往预后不佳,对单一TKI治疗响应较差。一项针对性的研究探索了奥希替尼联合多靶点抗血管生成药物安罗替尼一线治疗此类患者。结果令人振奋:中位无进展生存期(PFS)长达29.0个月,一年PFS率高达85%,即使对于伴有脑转移的患者,客观缓解率也达到了83.3%。该研究还发现,通过动态监测循环肿瘤DNA(ctDNA)的清除情况,可以有效预测治疗效果,为实现真正的个体化治疗开辟了新路径。如果您想了解安罗替尼的价格和购买渠道,可以咨询MedFind的AI问诊服务,获取更多详细信息。
1.4 揭示耐药新机制:动态监测指导后续治疗
随着治疗手段的进步,EGFR-TKI的耐药机制也在悄然改变。一项研究分析了一线使用吉非替尼或吉非替尼联合化疗后患者的耐药模式,发现经典的T790M突变发生率有所下降,尤其是在联合化疗组(19% vs. 37%)。这提示我们,耐药机制变得更加复杂多样。因此,在疾病进展后进行再次活检和基因检测至关重要,这能够帮助医生精准识别耐药原因,从而制定最有效的后续治疗方案。

二、 联合治疗策略百花齐放:多维度协同抗癌
本届ASCO年会展示了多种创新的联合治疗策略,它们通过不同机制协同作用,旨在突破耐药、激活免疫,为患者带来更优的生存获益。
2.1 免疫联合:唤醒被抑制的抗肿瘤免疫力
EGFR突变肺癌的肿瘤微环境常被称为“免疫荒漠”,常规免疫检查点抑制剂单药疗效不佳。一项创新研究尝试使用双特异性免疫刺激复合体AFM24(靶向EGFR和免疫细胞上的CD16A)联合PD-L1抑制剂阿替利珠单抗。该方案旨在将免疫细胞“拉”到肿瘤旁边并激活它们,从而重塑免疫微环境。初步结果显示,在经过多线治疗的患者中,客观缓解率达到23%,疾病控制率64%,中位PFS为5.5个月,为这类“免疫冷肿瘤”患者提供了化疗之外的新选择。
2.2 多药联合:覆盖不同耐药人群
另一项研究探索了新型双特异性抗体SMET12、JAK抑制剂托法替布与化疗的三联疗法。该研究巧妙地将患者分为初治、免疫耐药和TKI耐药三组,结果显示该联合方案在三组患者中均展现出良好的疗效和可控的安全性,尤其在初治患者中,客观缓解率高达83.3%,显示了其作为一线强化治疗的巨大潜力。
2.3 后线治疗新探索与“缓慢进展”管理
对于多线治疗失败的患者,尼莫替佐单抗(一种EGFR抑制剂)联合化疗的方案显示出希望,中位总生存期达到12.8个月。而对于出现“缓慢进展”或寡病灶进展的患者,在原有TKI治疗基础上联用安罗替尼,可将进展后的中位PFS从5.4个月显著延长至9.2个月,为患者争取了宝贵的治疗时间。
2.4 安全性警示:关注联合治疗的潜在风险
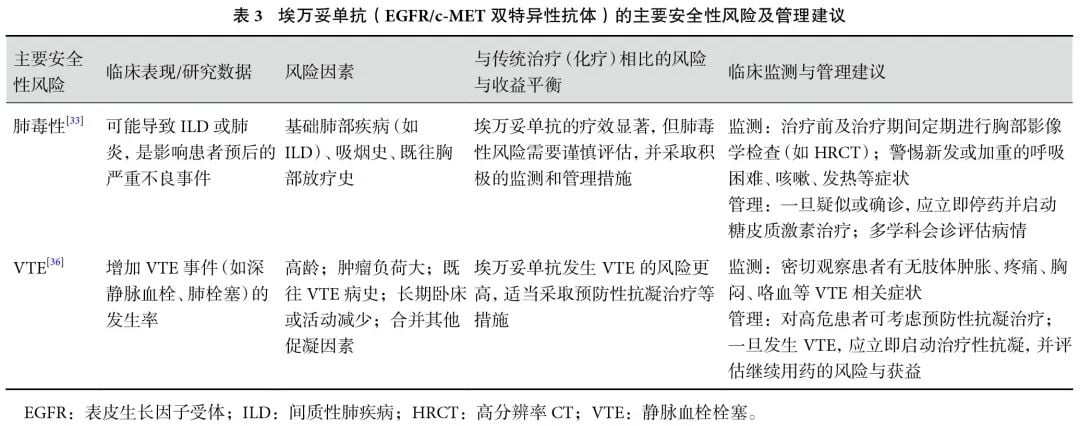
在追求疗效的同时,安全性管理同样重要。EGFR/c-MET双特异性抗体埃万妥单抗虽然疗效显著,但Meta分析提示,其联合方案可能会增加间质性肺疾病(ILD)/肺炎以及静脉血栓栓塞(VTE)的风险。例如,接受埃万妥单抗治疗的患者VTE风险是对照组的3.69倍。这警示临床医生在使用这些强效新药时,必须密切监测相关副作用,及时干预,确保患者的治疗安全。更多关于EGFR突变非小细胞肺癌的最新诊疗资讯,您可以访问MedFind官网。
三、 个体化精准治疗:看见每一位患者的独特性
精准医疗的真谛在于“因人而异”。本届ASCO年会的研究深入剖析了不同特征患者群体的分子景观和临床挑战,强调了个体化决策的重要性。
3.1 年轻患者与合并症患者的特殊考量
- 年轻患者:研究发现,年轻NSCLC患者虽然EGFR突变常见,但其基因突变谱与年长患者存在差异,免疫相关通路突变较少,而TP53等通路突变频繁,这可能需要不同的治疗策略。
- 合并纤维化间质性肺疾病(ILD)的患者:这是一个极其特殊的群体。研究显示,这类患者的EGFR突变率极低(3.0% vs. 33.0%),而KRAS G12D突变率较高。更重要的是,他们在接受放疗、靶向治疗(如奥希替尼)或免疫治疗时,发生致命性肺炎的风险显著增加。因此,对于LC-ILD患者,治疗决策必须慎之又慎。
3.2 基因特征预测转移风险与治疗可及性
- 骨转移风险:一项研究发现,特定的EGFR突变亚型,尤其是错义突变,可能与更高的骨转移风险相关。这一发现有助于早期识别高危人群,并进行针对性的骨骼健康管理。
- 社会经济因素:令人深思的是,一项大规模真实世界研究显示,患者的社会经济地位(通过区域剥夺指数衡量)显著影响其获得EGFR靶向药治疗的机会。这揭示了精准医疗在普及过程中面临的现实挑战,即如何确保每一位“分子可靶向”的患者都能“实际可治疗”。

总结与展望:携手迈向EGFR肺癌治疗的未来
2025年ASCO年会为EGFR突变型NSCLC的治疗描绘了一幅充满希望的蓝图。联合治疗策略正成为克服耐药、提升疗效的核心驱动力,而个体化治疗则要求我们更加关注患者的分子特征、临床特征乃至社会经济背景。未来5到10年,我们将见证更多创新药物的诞生和优化联合方案的推广。
然而,挑战依然存在。耐药机制的复杂性、特殊人群的治疗困境、新药的安全性管理以及精准治疗的公平可及性,都是我们需要共同面对的课题。对于患者而言,紧跟前沿进展,与医生充分沟通,并积极进行基因检测,是制定最佳个体化治疗方案的关键。
在抗癌的征途上,信息与支持至关重要。MedFind致力于为全球华人癌症患者提供一站式服务,从前沿的抗癌资讯,到便捷可靠的药品代购渠道,再到智能的AI问诊助手,我们希望能成为您最坚实的后盾。随着科学的不断进步,我们坚信,EGFR突变肺癌的治疗必将迎来更大的突破,为更多患者带来长久生存的希望。





