精准医疗新证据:泛癌种靶向治疗的真实世界价值
随着精准肿瘤学的发展,基于个体肿瘤分子特征的个性化治疗已成为癌症治疗的核心。下一代测序(NGS)技术能够高效检测多种基因变异,为患者精准匹配治疗方案。然而,这些靶向疗法在真实临床环境中的效果如何?一项名为KISMET的真实世界研究,深入探讨了携带BRAF V600E突变、高肿瘤突变负荷(TMB-H)及RET融合这三类泛癌种分子变异的晚期癌症患者,接受基因匹配疗法(GMT)后的临床结局。如果您对自己的基因检测报告有疑问,或希望了解更多靶向药物信息,可以咨询MedFind的AI问诊服务。
关键研究发现:数据揭示靶向治疗显著优势
该研究回顾性分析了超过一万名晚期癌症患者的数据,发现在可评估的患者中:
- BRAF V600E突变检出率为6.5%
- TMB-H检出率为11.2%
- RET融合检出率为0.6%
研究结果明确显示,与未接受匹配疗法的患者相比,接受基因匹配靶向治疗(GMT)的患者获得了显著更优的临床获益:
- 客观缓解率 (ORR):GMT组为 55.6%,而非GMT组仅为 12.8%。
- 无进展生存期 (mPFS):GMT组为 9.6个月,而非GMT组为 3.7个月。
这些数据强有力地证明,针对特定基因靶点的治疗能为晚期癌症患者带来切实的生存改善。MedFind致力于为癌症患者提供全球最新的靶向药代购服务,帮助患者跨越地域障碍,及时获取救命良药。
各靶点队列疗效深度解析
1. BRAF V600E突变队列
BRAF V600E突变存在于多种癌症中,尤其在乳头状甲状腺癌(51.6%)和黑色素瘤中较为常见。在该队列中,接受BRAF抑制剂等靶向治疗的患者:
- ORR 达到 51%,远高于非匹配治疗组的17.6%。
- mPFS 达到 9.2个月,相比非匹配治疗组的4.2个月有明显延长趋势。
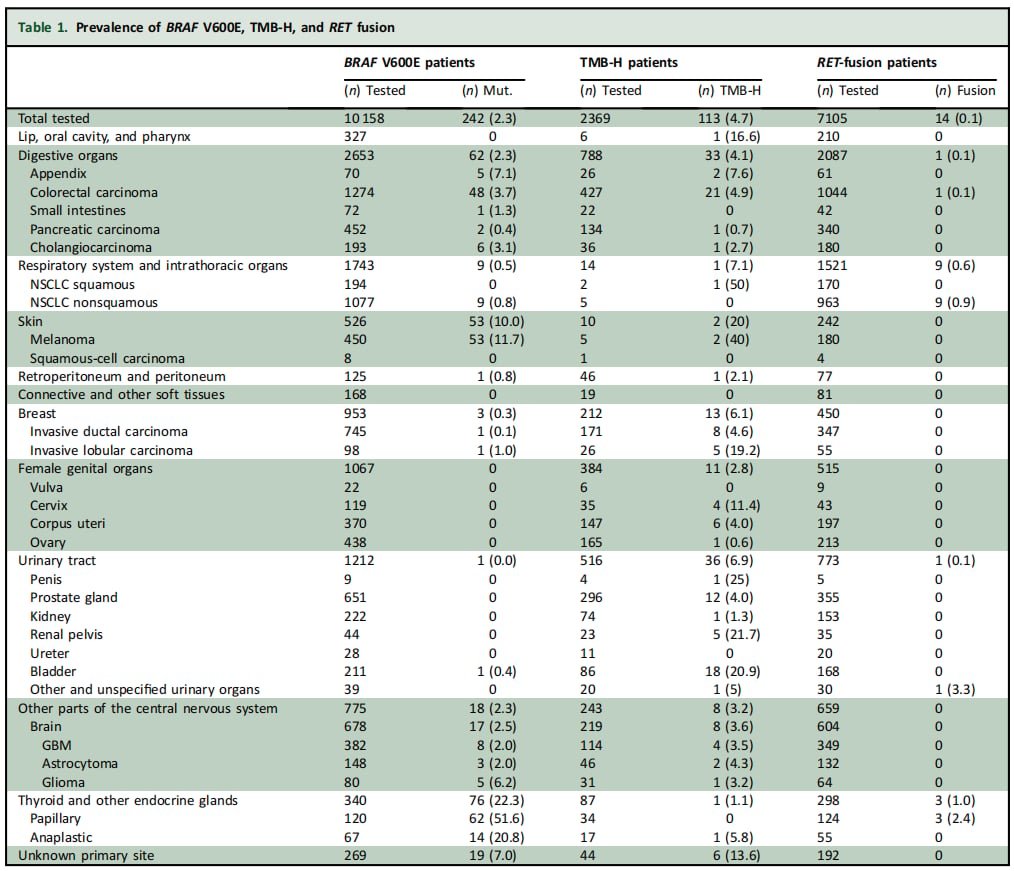
表1:不同肿瘤类型中基因变异的检出情况
2. 高肿瘤突变负荷 (TMB-H) 队列
TMB-H(定义为TMB≥10 mut/Mb)是免疫治疗的有效生物标志物。研究发现,在TMB-H患者中,接受PD-1/PD-L1抑制剂治疗(即GMT)的患者获益显著:
- ORR 高达 57.6%,而非GMT组仅为9.5%。
- mPFS 显著延长至 7.9个月,优于非GMT组的3.7个月。
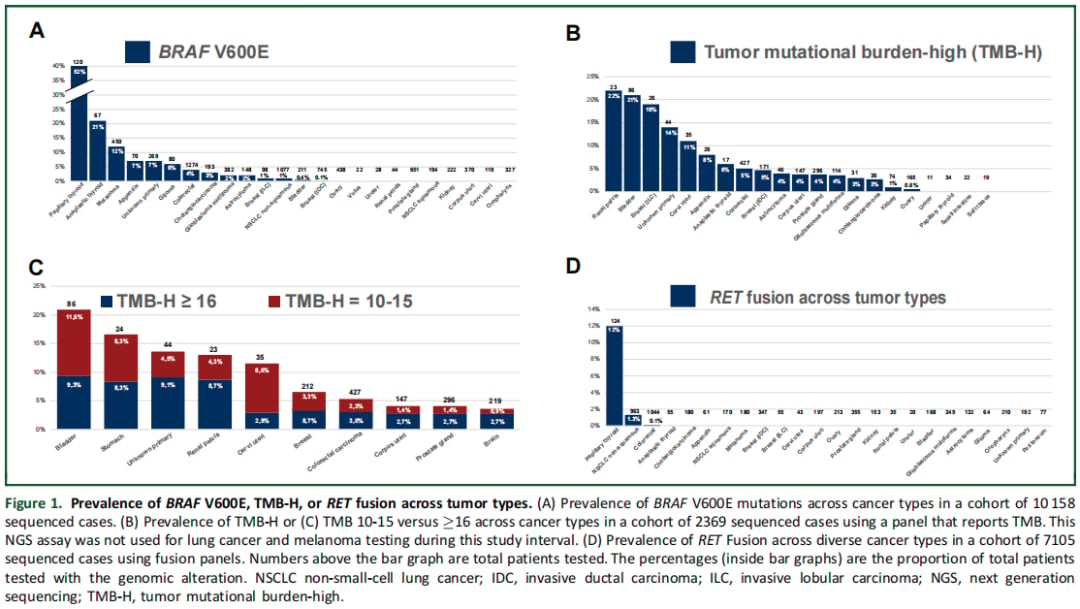
图1:各靶点在不同癌种中的分布
3. RET融合队列
尽管RET融合是一种罕见的分子变异,主要见于非小细胞肺癌和甲状腺癌,但其对靶向治疗的响应极为出色。在接受RET抑制剂治疗的患者中:
- ORR 达到了惊人的 75%,其中3例患者实现完全缓解(CR)。
- mPFS 长达 15.0个月,显示出持久的疗效。
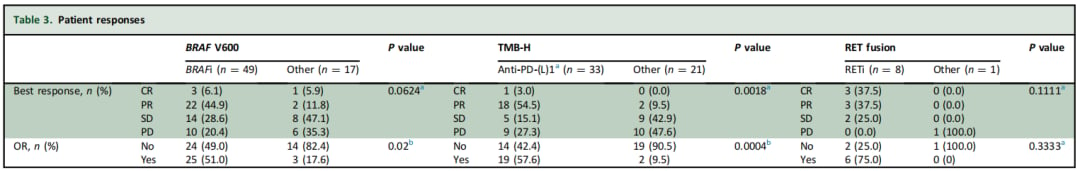
表3:各队列治疗缓解率对比
研究结论与临床启示
这项大规模的真实世界研究证实,BRAF V600E突变、TMB-H和RET融合这三个泛癌种靶点在多种晚期实体瘤中普遍存在,并且针对这些靶点的精准治疗能够显著改善患者的客观缓解率和无进展生存期。这一结论强力支持在临床实践中,应为晚期癌症患者常规进行全面的NGS基因检测,以识别潜在的治疗靶点,从而制定更有效的个体化治疗策略。
总而言之,精准医疗的真实世界研究正在不断验证靶向药物的临床价值。对于患者而言,了解自身的基因变异信息,是开启有效治疗大门的关键一步。更多前沿的抗癌资讯和药物信息,欢迎访问MedFind官网获取。
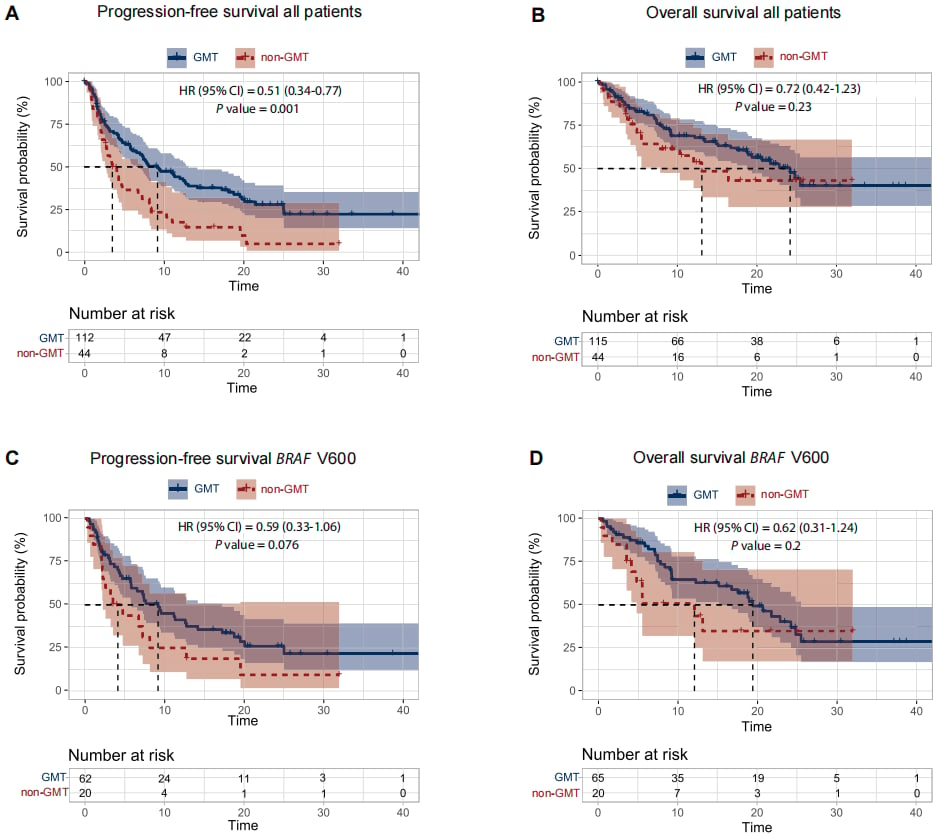
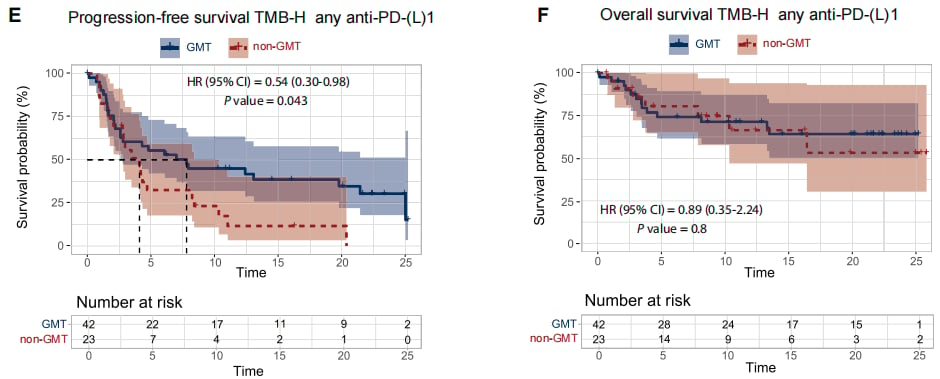

图2:各队列生存曲线对比





