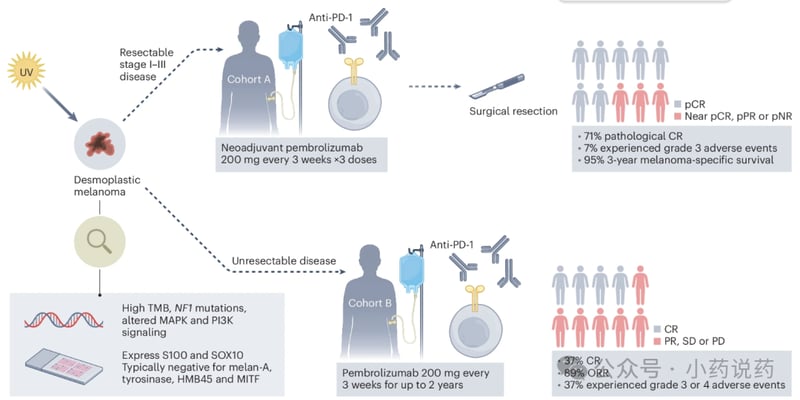
随着全球癌症发病率和死亡率的持续攀升,开发更精准、更高效的抗癌疗法已成为医学界面临的紧迫挑战。传统化疗和放疗在杀伤癌细胞的同时,也常常因缺乏特异性而损伤正常组织,导致严重的副作用。为此,靶向治疗应运而生,它能将强效药物精准递送至肿瘤部位,实现“精确打击”。在这一领域,继抗体偶联药物(ADC)之后,一种名为核酸适配体偶联药物(Aptamer-Drug Conjugates, ApDC)的新策略正展现出巨大的潜力。
近期,由谭蔚泓院士领导的研究团队在国际期刊Signal Transduction and Targeted Therapy上发表了一项重要研究,详细介绍了一种名为Sgc8c-M的新型ApDC药物。这项研究从啮齿类动物到非人灵长类动物,全面评估了Sgc8c-M的抗癌效果与安全性,结果令人振奋。

什么是核酸适配体偶联药物(ApDC)?
ApDC是一种创新的药物设计,它将具有靶向功能的核酸适配体(Aptamer)与高效的细胞毒性药物通过连接子结合在一起。与大家熟知的ADC药物类似,其核心优势在于“精准制导”。
核酸适配体是一段短的单链DNA或RNA,能通过其特殊的三维结构精准识别并结合癌细胞表面的特定蛋白。相比于ADC中使用的抗体,核酸适配体具有分子量小、组织穿透力强、合成简便、生产成本低和免疫原性低等显著优点,使其成为开发下一代靶向药物的理想选择。对于癌症患者而言,及时获取前沿的药物信息至关重要。如果您对Sgc8c-M或其他靶向药物有任何疑问,可以咨询MedFind的AI问诊服务,获取专业的解答。
Sgc8c-M:精准靶向PTK7的抗癌新星
此次研究的主角Sgc8c-M,就是一种针对蛋白酪氨酸激酶-7(PTK7)靶点的ApDC。PTK7在多种实体瘤和血液肿瘤中过度表达,是公认的肿瘤治疗靶点。
Sgc8c-M的结构十分精巧:
- 导航弹头: 经典的PTK7核酸适配体Sgc8c,负责精准识别并结合表达PTK7的癌细胞。
- 强效载荷: 高效的抗有丝分裂剂MMAE,负责在进入癌细胞后将其杀灭。
通过这种设计,Sgc8c-M能够像“生物导弹”一样,将杀伤力强大的MMAE选择性地递送至癌细胞内部,从而最大化疗效并降低对健康组织的损害。
Sgc8c-M在临床前研究中的卓越表现
研究团队在多种PTK7过表达的癌症模型(包括细胞系来源和患者来源的异种移植瘤模型)中验证了Sgc8c-M的疗效。结果显示,Sgc8c-M能够有效诱导肿瘤持续消退,其抗癌效果显著优于单独使用的MMAE、传统化疗药物紫杉醇,甚至优于一款同样靶向PTK7的ADC药物。
Sgc8c-M的出现,为PTK7过表达的癌症患者提供了新的治疗可能。MedFind致力于为患者提供全球最新的靶向药,您可以在我们的药品代购服务页面查询更多药物信息。
Sgc8c-M的安全性与药代动力学特征
除了卓越的疗效,药物的安全性是患者和医生最为关心的问题。药代动力学(PK)研究显示,Sgc8c-M在注射后能迅速在肿瘤组织中富集,并维持有效的药物浓度,同时能快速地从血液和正常组织中清除。在大鼠模型中,超过75%的药物在24小时内通过尿液和粪便排出体外。
更重要的是,毒理学研究证实,在高效治疗剂量下,Sgc8c-M是安全的。即使在极高剂量下产生的毒性也是可控且可逆的。在更接近人体的食蟹猴模型中,Sgc8c-M同样表现出良好的耐受性和剂量依赖性,多次给药后未观察到明显的药物蓄积现象。

总结与展望
总而言之,这项全面的临床前研究有力地证明了Sgc8c-M作为一种新型抗癌药物的巨大潜力。其出色的疗效和良好的安全性特征,为ApDC这一新兴药物类别的临床转化提供了宝贵的科学依据。随着研究的深入,我们期待Sgc8c-M能早日进入临床试验阶段,为广大癌症患者带来新的治疗选择。关注MedFind抗癌资讯,我们将持续为您追踪报道最新的药物研发进展。