引言:颠覆性癌症与自身免疫病治疗新愿景
想象一下,未来对抗顽固的癌症或棘手的自身免疫病,不再需要繁琐的体外细胞改造,也不必经历“清空”免疫系统的严酷化疗。只需一次注射,智能药物就能在体内精准地将普通免疫细胞“编程”为强大的“细胞杀手”,对病灶发起毁灭性打击。这曾是科幻般的设想,如今正逐步成为现实。
2025年6月19日,《Science》杂志刊登了一项里程碑式的研究——“In vivo CAR T cell generation to treat cancer and autoimmune disease”。这项研究详细阐述了一种创新策略:利用靶向性脂质纳米颗粒(tLNPs),将信使RNA(mRNA)高效、安全地递送至体内的T细胞中,从而在患者体内直接“制造”出能够识别并攻击癌细胞或致病B细胞的嵌合抗原受体T细胞(CAR-T)。这项技术不仅在小鼠模型中展现了卓越的肿瘤控制能力,更在与人类更为接近的食蟹猴模型中实现了深度、安全的B细胞清除,并观察到了令人振奋的“免疫重置”现象。这不仅为血液肿瘤治疗带来了“即用型”(off-the-shelf)的希望,更有可能彻底改变系统性红斑狼疮、多发性硬化等自身免疫病的治疗格局。

传统CAR-T疗法:高昂、复杂且受限的“体外战争”
在深入了解这项革命性技术之前,我们有必要回顾一下传统的CAR-T疗法。这是一种被称为“活的药物”的个性化细胞免疫疗法,其基本流程是为每位患者的免疫系统量身定制一支“特种部队”。
首先,医生从患者血液中分离出T细胞。接着,这些T细胞被送往专业实验室,利用经过改造的病毒(通常是慢病毒)作为载体,将一段巧妙设计的基因(CAR基因)整合到T细胞的DNA中。这个CAR基因编码了一个“嵌合抗原受体”,它包含两个关键部分:一部分像“精确制导的雷达”,能够特异性地识别癌细胞表面的特定“标签”(如B细胞恶性肿瘤表面的CD19抗原);另一部分则是“激活信号开关”,一旦“雷达”锁定目标,就会立即激活T细胞,使其变身为冷酷的“杀手”。
经过体外扩增,这些被成功改造和“武装”的CAR-T细胞数量达到数亿甚至数十亿级别后,再被回输到患者体内。在此之前,患者通常需要接受一轮“淋巴细胞清除性化疗”,目的是为了“清场”,给这些精锐的CAR-T部队腾出足够的生存和作战空间,减少体内原有免疫细胞的压制。
这场“体外战争”在治疗复发或难治性B细胞白血病、淋巴瘤和多发性骨髓瘤等方面取得了前所未有的持久疗效,让许多濒临绝境的患者重获新生。然而,其广泛应用仍面临诸多挑战:
- 高昂的成本与复杂性: 整个过程极其复杂,耗时数周,成本高达数十万美元,且对生产设施和技术人员的要求极高。这导致其产能有限,难以规模化,许多患者因等不起或付不起而错失良机。
- 地理限制: 只有少数顶级的医疗中心具备开展CAR-T治疗的资质和能力,对于居住在偏远地区的患者来说,无疑是一道难以逾越的地理屏障。
- 化疗的副作用: 淋巴细胞清除性化疗虽然能提升CAR-T细胞的疗效,但其本身对患者身体的打击巨大,会带来一系列副作用,并非所有患者都能耐受。
- 潜在的基因毒性风险: 使用整合性病毒载体,意味着CAR基因会永久地嵌入T细胞的基因组中。虽然罕见,但这存在着潜在的基因毒性风险,即可能意外激活癌基因或抑制抑癌基因,从而引发新的肿瘤。近期关于CAR-T治疗后出现T细胞淋巴瘤的报道,也让监管机构和医学界对此保持高度警惕。
当我们将目光转向自身免疫病时,这些挑战变得更加突出。这类疾病影响的人群远比B细胞恶性肿瘤要庞大得多。虽然近期案例显示靶向B细胞的CAR-T疗法在治疗重度自身免疫病方面展现了惊人潜力,但若要将这种昂贵、复杂且存在潜在风险的疗法推广到如此庞大的患者群体中,现有的“体外”模式显然是不可持续的。
世界迫切需要一种更简单、更安全、更经济、更普惠的CAR-T疗法。这项研究正是对这一需求的有力回应,旨在绕过所有体外操作的壁垒,将治疗的战场直接搬到患者体内,从而开启一个全新的时代。
体内CAR-T疗法核心技术:纳米快递与精准导航
要在体内直接“编程”T细胞,首先需要一个高效且精准的“快递系统”。这个系统需要能将编码CAR的mRNA“包裹”起来,保护它不被体内的酶降解,并将其准确无误地送到T细胞手中。脂质纳米颗粒(LNP)——这项技术因新冠mRNA疫苗而家喻户晓——成为了首选。
然而,传统的LNP并非完美。静脉注射的LNP大部分最终会聚集在肝脏。对于需要精准靶向免疫细胞的治疗而言,大量的“脱靶”递送不仅会浪费“弹药”,更可能引发肝脏毒性。因此,研究团队的首要任务是设计一款全新的、能够“绕开”肝脏、直奔免疫器官的靶向性脂质纳米颗粒(tLNP)。
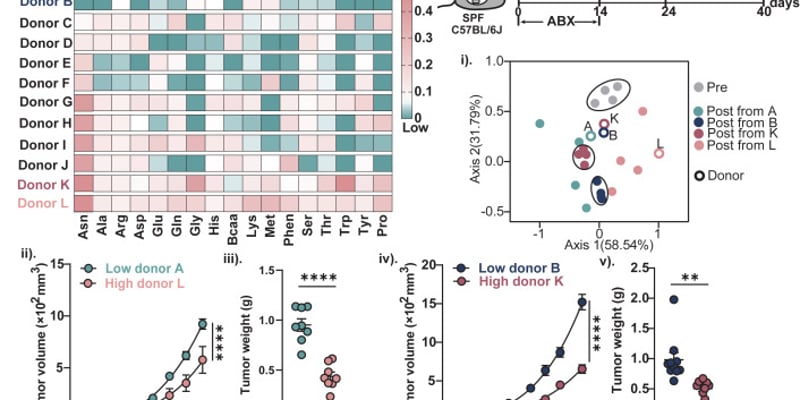
研究人员巧妙地从LNP的核心部件——可电离脂质入手,合成了一种名为Lipid 829(L829)的新型可电离脂质,并用它构建了新的tLNP。实验结果令人振奋:与传统LNP相比,注射了L829-tLNP的小鼠,其肝脏的荧光信号显著降低,而在脾脏——一个重要的免疫器官,富含T细胞——则显示出更具特异性的信号。这表明L829-tLNP成功地减少了肝脏的“脱靶”递送,且在肝脏中的清除速度非常快,对肝脏的潜在负担更小,生物降解性更好。
更重要的是,在对LNP毒性敏感的大鼠和食蟹猴模型中,L829-tLNP表现出良好的耐受性,肝功能指标显著低于对照组。这一系列证据清晰地表明,研究人员成功打造出了一款性能卓越的“纳米快递车”,为后续在体内精准、安全地改造T细胞奠定了坚实基础。
有了性能优越的“快递车”,下一步就是为它安装上“GPS导航系统”,确保它能从体内数以万亿计的细胞中,精准地找到它的目标——T细胞。研究人员希望能够实现更精细的靶向,即优先改造CD8+ T细胞。CD8+ T细胞是名副其实的“杀手”,能够直接识别并摧毁被病毒感染的细胞或肿瘤细胞。选择性激活CD8+ T细胞,有望在保证强大杀伤力的同时,最大限度地降低“细胞因子释放综合征”(CRS)等副作用。
因此,研究团队的策略是,在这款L829-tLNP的表面,偶联上一种能够特异性结合CD8分子的抗体。实验证明,在接受了CD8-L829-tLNP注射的小鼠和人源化小鼠中,CD8+ T细胞群体中表达mCherry蛋白的比例非常高,而CD4+ T细胞、B细胞以及单核细胞中几乎检测不到表达。这证明了CD8靶向策略的高度特异性,为开发更安全、更可控的体内CAR-T疗法铺平了道路。
mRNA“作战指令”优化:打造最强CAR-T细胞
有了顶级的“快递车”(L829-tLNP)和精准的“GPS”(CD8抗体),现在是时候关注最核心的部分了——“货物”本身,即编码CAR的mRNA。这个mRNA就是发送给T细胞的“作战指令”,其设计的优劣直接决定了生成的CAR-T细胞的表达水平、持久性和战斗力。
研究人员并没有满足于使用现成的CAR序列,而是启动了一项雄心勃勃的“软件优化”计划。他们从两个经典的第二代抗CD19 CAR结构出发,运用多种生物信息学和分子生物学工具,对mRNA序列进行了全方位的改造和筛选,主要集中在非翻译区(UTRs)的优化和密码子优化。通过构建包含多种UTR和密码子优化方案的mRNA文库,并严格筛选,一个名为“Improved CAR2”的优化设计脱颖而出。
与原始的CAR2设计相比,用这个新“指令”生成的CAR-T细胞表现出全方位的提升:首先,表达水平更高;其次,功能更强大,在与CD19阳性的肿瘤细胞共培养时,分泌的IFN-γ水平是原始版本的数倍,显示出更强的激活状态和杀伤潜力;最后,这种优化后的CAR-T细胞还展现了出色的“连环杀伤”能力。更重要的是,这种性能的提升成功地转化到了体内,在人源化小鼠模型中,脾脏T细胞表面的CAR表达水平显著高于接受原始版本tLNP治疗的小鼠。
通过这一系列的优化工作,研究人员不仅证明了mRNA设计的重要性,还成功地为他们的体内CAR-T系统配备了一套“顶配软件”,确保了生成的CAR-T细胞不仅数量充足,而且个个都是训练有素、战力爆表的“超级士兵”。
小鼠与灵长类动物验证:B细胞清除与肿瘤控制的惊人效果
手握“顶级快递车”、“精准GPS”和“最强作战软件”的全套技术,研究人员进入了关键的体内验证阶段。他们设计了巧妙的小鼠实验,旨在回答两个核心问题:第一,这种体内生成的CAR-T细胞,能否有效清除B细胞,从而在理论上治疗自身免疫病?第二,它能否在活体动物模型中控制甚至根除肿瘤?
在自身免疫病模型的概念验证中,研究人员发现,来自自身免疫病患者的CD8+ T细胞,可以被CD8-L829-tLNP同样高效地改造为CAR-T细胞,并且能够高效地裂解来自同一患者的自体B细胞。在人源化小鼠体内的B细胞“闪电战”实验中,B细胞的数量在短短1小时内就开始急剧下降,到3小时后几乎被完全清除,这种深度清除状态一直维持到24小时。
在白血病模型的“清零行动”中,结果令人震撼。接受10微克CD8-L829-tLNP-CD19治疗的小鼠,其肿瘤生长得到了显著的控制。最激动人心的发现在30微克剂量组:接受该剂量治疗的小鼠,在第一次给药后仅2天,体内的肿瘤光点就几乎完全消失。在第二次给药后的第3天,所有5只小鼠体内的肿瘤都被彻底清除,影像上看不到任何肿瘤信号。
小鼠模型的成功固然可喜,但要在人体上应用,还必须跨过一道更重要的门槛——在与人类亲缘关系和免疫系统更为接近的灵长类动物中进行验证。食蟹猴成为了这次“终极考验”的主角。研究人员巧妙地换用了能够识别猴子B细胞表面CD20抗原的CAR,并组装了最终的“作战武器”:搭载了抗猴CD20 CAR mRNA的CD8靶向L829-tLNP。
疗效是检验这项技术的“金标准”。结果显示,这种体内CAR-T疗法在食蟹猴体内展现了惊人的B细胞清除效率。在第一次给药后仅6小时,外周血中的B细胞数量就开始急剧下降,到24小时已接近检测不到的水平。解剖分析也证实,在脾脏和淋巴结这些B细胞聚集的“大本营”中,B细胞同样被大量清除。同时,CAR的表达也呈现出精准靶向性,在较高剂量组中,高达85%的CD8+ T细胞和95%的CD8+ NK细胞表达了CAR,而CD4+ T细胞上的CAR表达则非常微弱。
在安全性方面,治疗在绝大多数情况下表现出良好的耐受性。观察到的副作用,如一过性的肝酶升高和细胞因子水平上升,都与传统CAR-T疗法中“在靶”药理作用所预期的反应一致。研究人员还发现,两剂给药方案与三剂方案同样有效,但其安全性更高,这为未来临床方案的设计提供了更安全、更简洁的选项。
在完成了B细胞清除的使命后,这些短暂表达的CAR-T细胞会逐渐消失。那么,被清除的B细胞会如何恢复?这引出了该研究中最令人兴奋的发现之一。在停药后,大约从第21天开始,B细胞开始恢复。但关键在于,这些“新生”的B细胞与治疗前的B细胞在构成上发生了根本性的变化。分析显示,治疗后重新恢复的B细胞群体中,绝大多数是“初始B细胞”(Naïve B cells)。而那些可能携带了致病性“记忆”的记忆B细胞,则被大量清除。这种现象,被称为“免疫重置”(immune reset)。这一发现在灵长类动物模型中的证实,极大地提升了该疗法在治疗自身免疫病方面的想象空间。
展望未来:开启“现货型”细胞疗法新纪元
这项发表在《Science》上的研究,无疑是细胞与基因治疗领域的一次重大突破。它系统性地构建并验证了一套全新的、可在体内直接生成CAR-T细胞的治疗平台。
通过巧妙设计的新型脂质L829,研究人员解决了LNP肝脏递送的难题;通过精准的CD8抗体靶向,他们实现了对“精英杀手”T细胞的选择性编程;通过对CAR mRNA的深度优化,他们确保了生成的CAR-T细胞具备最强大的战斗力。而这一切,都在非病毒、非整合的瞬时性mRNA技术框架下完成,从根本上规避了传统CAR-T疗法中由病毒载体整合基因组所带来的长期安全隐忧。
从人源化小鼠模型中的肿瘤“清零”,到食蟹猴模型中的B细胞深度清除和“免疫重置”,这项研究以坚实的数据链,描绘了一幅激动人心的未来图景。它将CAR-T疗法从一个需要为每个患者“定制生产”的复杂手工业,带向了一个有望实现“现货供应”(off-the-shelf)、即取即用的工业化时代。对于寻求海外靶向药代购或癌症靶向药新选择的患者而言,这项技术无疑带来了新的希望。
当然,从临床前研究到真正应用于人类患者,还有很长的路要走。在人体中达到理想疗效所需的剂量、最佳的给药方案、如何应对重复给药可能产生的免疫原性等问题,都需要在未来的临床试验中进行严谨的探索和回答。
但无论如何,这项工作已经为我们打开了一扇通往未来的大门。一个更安全、更便捷、更普惠的CAR-T疗法新纪元,正伴随着这项研究,拉开序幕。它所点燃的希望之火,不仅将照亮癌症患者的前行之路,也为全球数亿自身免疫病患者带来了前所未有的曙光。我们有理由相信,在不远的将来,“一针编程免疫”将不再是科幻,而是改变无数人命运的医学现实。
参考文献
Hunter TL, Bao Y, Zhang Y, Matsuda D, Riener R, Wang A, Li JJ, Soldevila F, Chu DSH, Nguyen DP, Yong QC, Ross B, Nguyen M, Vestal J, Roberts S, Galvan D, Vega JB, Jhung D, Butcher M, Nguyen J, Zhang S, Fernandez C, Chen J, Herrera C, Kuo Y, Pica EM, Mondal G, Mammen AL, Scholler J, Tanis SP, Sievers SA, Frantz AM, Adams GB, Shawver L, Farzaneh-Far R, Rosenzweig M, Karmali PP, Bot AI, June CH, Aghajanian H. In vivo CAR T cell generation to treat cancer and autoimmune disease. Science. 2025 Jun 19;388(6753):1311-1317. doi: 10.1126/science.ads8473. Epub 2025 Jun 19. PMID: 40536974.