结直肠癌(Colorectal Cancer, CRC)作为全球范围内常见的恶性肿瘤,其高发病率和死亡率对人类健康构成严重威胁。尽管免疫检查点抑制剂等新型疗法在多种癌症中取得了突破,但在结直肠癌领域的应用仍面临不少挑战。因此,深入剖析结直肠癌复杂的肿瘤微环境,识别并验证新的治疗靶点,对于开发更有效的抗癌药和靶向治疗策略至关重要。
近期,一项由西京医院和空军军医大学研究团队合作完成的重要研究,深入探讨了SPP1⁺巨噬细胞在结直肠癌发生、发展及转移过程中的作用。该研究整合了单细胞、空间转录组学以及批量测序等前沿技术,为理解肿瘤微环境中巨噬细胞的功能提供了新的视角。
单核细胞/巨噬细胞在结直肠癌及肝转移中的动态变化
研究人员通过单细胞测序技术,详细描绘了单核细胞和巨噬细胞在正常结直肠组织、原发性结直肠癌以及结直肠癌肝转移(CRLM)样本中的转录组图谱。分析发现,随着疾病的进展,这些免疫细胞的基因表达谱发生了显著改变,涉及血管生成、上皮–间充质转化(EMT)和缺氧等与肿瘤恶性行为密切相关的通路。
进一步的轨迹分析揭示,单核细胞在肿瘤微环境中逐步分化成熟,先转化为FCN1⁺巨噬细胞,随后进一步极化为C1QC⁺和SPP1⁺巨噬细胞。特别值得关注的是,SPP1基因在结直肠癌原发灶和肝转移灶中的表达水平显著上调,提示SPP1⁺巨噬细胞可能在肿瘤进展中扮演关键角色。
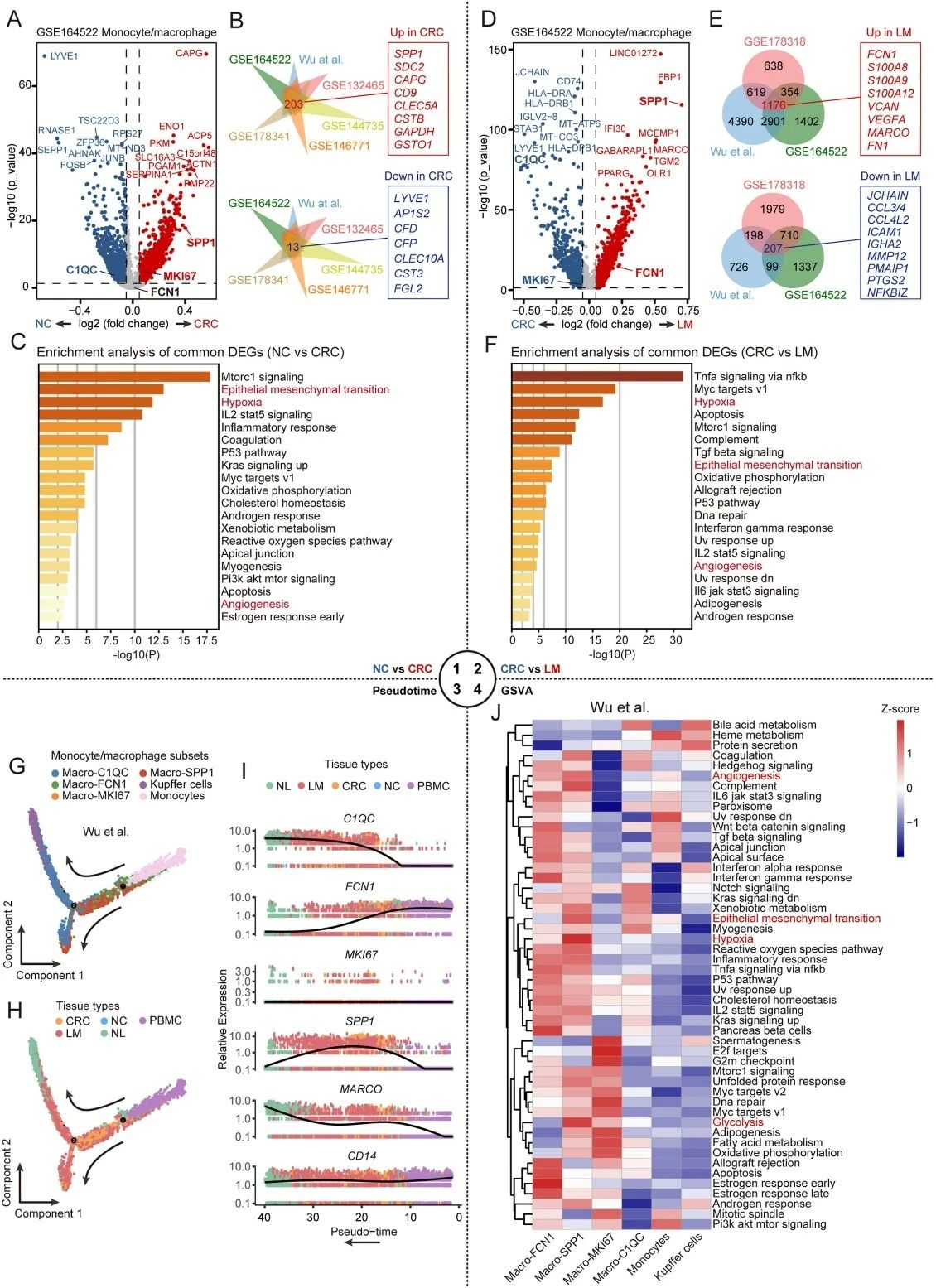
图1:单核细胞/巨噬细胞在CRLM过程中的分化与变化
SPP1⁺巨噬细胞的鉴定及其促肿瘤功能
研究团队在结直肠癌组织中成功鉴定出四种主要的巨噬细胞亚群:FCN1⁺、C1QC⁺、SPP1⁺和MKI67⁺巨噬细胞。通过对不同阶段肿瘤样本的分析,研究人员发现SPP1⁺巨噬细胞的数量和比例随着结直肠癌的发生、进展和转移而持续增加。这一发现强有力地表明,SPP1⁺巨噬细胞是推动结直肠癌生长和转移的重要细胞群体。
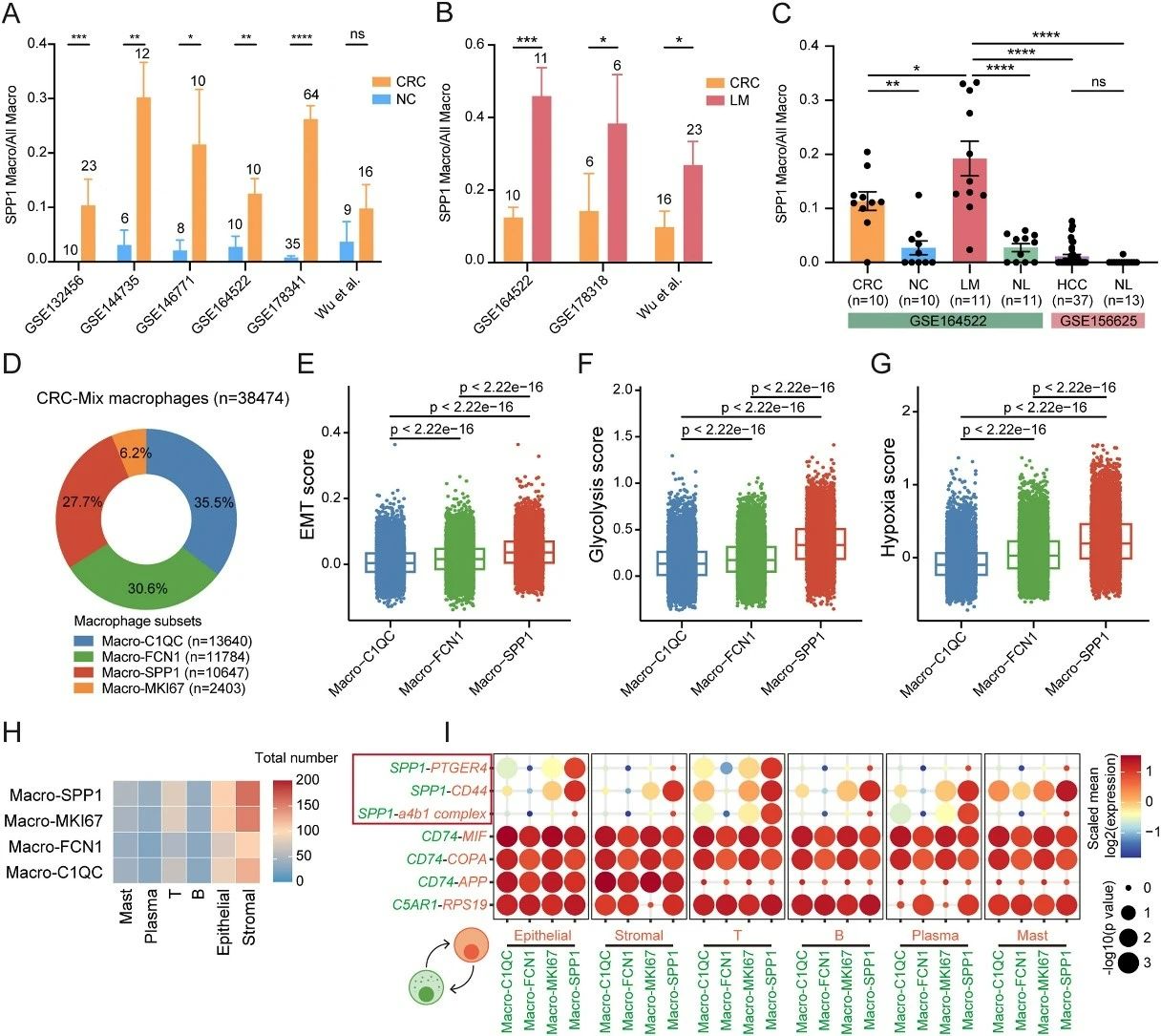
图2:SPP1⁺巨噬细胞在组织中的分布及其潜在作用
SPP1⁺巨噬细胞与结直肠癌进展、转移及不良预后密切相关
利用大规模结直肠癌患者数据集进行分析,结果显示SPP1基因在晚期(III/IV期)、T3/4和N1-3期样本中的表达水平显著高于早期(I/II期)、T1/2和N0期样本。同时,SPP1在肝转移样本中的表达也远高于原发性结直肠癌样本。
单变量Cox回归分析进一步证实,SPP1的高表达与结直肠癌患者较差的生存预后显著相关。此外,SPP1/CD68高表达的患者群体通常年龄更大,肿瘤分期更晚,更容易发生淋巴结转移,且表现出更高的微卫星不稳定性(MSI-H)和肿瘤突变负荷(TMB),生存时间也更短。这些结果提示SPP1⁺巨噬细胞是预测结直肠癌患者预后的重要生物标志物。
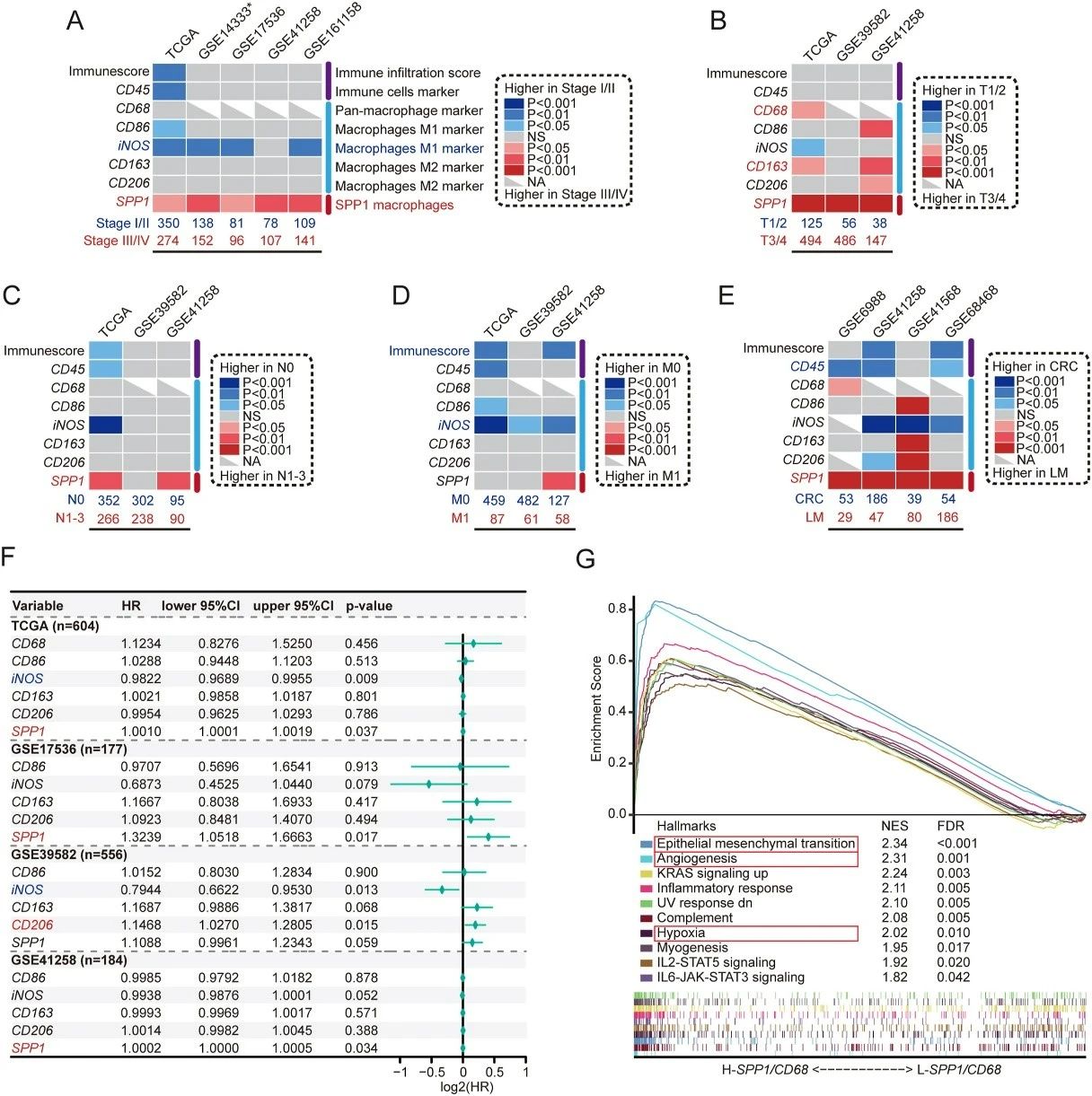
图3:SPP1⁺巨噬细胞与结直肠癌进展、转移及预后的关联
化疗的影响与现有靶向巨噬细胞疗法的局限性
研究还探讨了术前化疗对肿瘤微环境中巨噬细胞的影响。结果显示,化疗能够显著降低结直肠癌巨噬细胞中SPP1的表达,尤其是在对化疗有良好应答的患者中,这提示SPP1可能与治疗敏感性有关。
然而,针对巨噬细胞的靶向免疫治疗,特别是靶向CSF1-CSF1R轴的策略,在临床研究中并未取得预期效果。该研究揭示了其中一个重要原因:靶向CSF1-CSF1R轴虽然能耗竭部分巨噬细胞亚群,但却保留了促肿瘤的SPP1⁺巨噬细胞,甚至可能导致保护性的C1QC⁺巨噬细胞减少,从而限制了治疗的有效性。
结语:SPP1⁺巨噬细胞——结直肠癌治疗的新靶点?
这项全面深入的研究系统地解析了SPP1⁺巨噬细胞在结直肠癌中的起源、分布、临床意义、功能通路及其对治疗的潜在影响。基于这些发现,研究人员提出了SPP1⁺巨噬细胞模型理论,为理解结直肠癌肝转移过程中巨噬细胞的复杂变化提供了框架,并对未来的临床诊断和治疗方向具有指导意义。
研究结果强调了开发更精准、能有效靶向或调节SPP1⁺巨噬细胞的新型靶向药或抗癌药策略的必要性。对于正在寻求更有效治疗方案的结直肠癌患者,了解最新的研究进展至关重要。有时,这些前沿疗法或相关药物可能尚未在国内上市,患者可能需要考虑海外购药的途径。
面对复杂的癌症治疗决策,患者和家属往往需要专业的指导。除了了解药物信息,利用AI问诊服务可以帮助患者梳理病情,获取初步的治疗建议和信息,辅助决策。MedFind平台不仅提供靶向药及仿制药代购服务,还汇集了丰富的抗癌资讯,包括药物信息、诊疗指南等,帮助患者获取全面的抗癌知识。
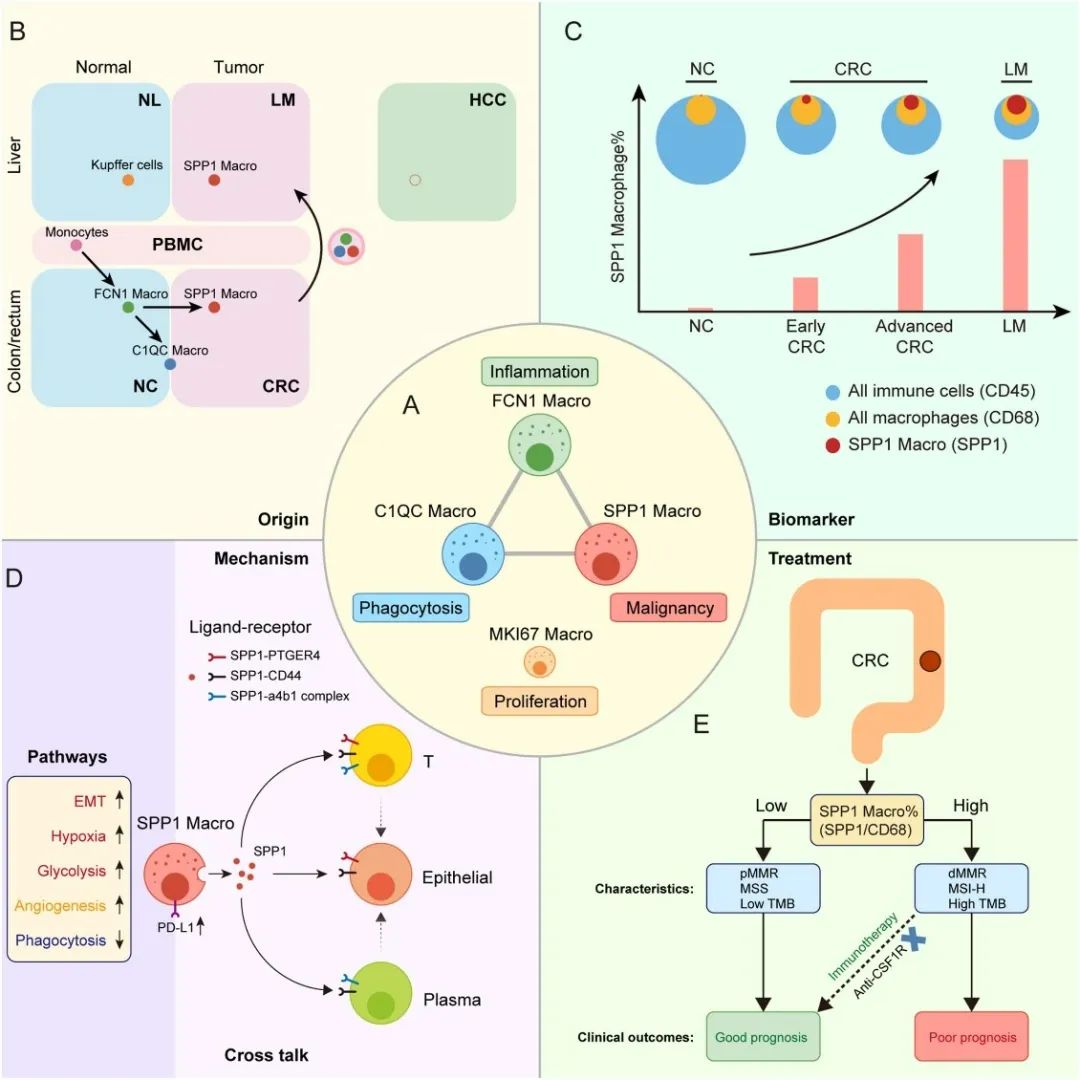
图4:结直肠癌中SPP1⁺巨噬细胞模型的示意图
文章来源
免费全文下载链接:
https://www.sciencedirect.com/science/article/pii/S2352304224001375
引用这篇文章:
Xie Z, Zheng G, Niu L, et al. SPP1+ macrophages in colorectal cancer: Markers of malignancy and promising therapeutic targets. Genes Dis. 2025;12(3):101340.