近年来,肿瘤免疫检查点治疗(ICT)为癌症治疗带来了革命性的进步。通过唤醒患者自身的免疫系统来对抗癌细胞,ICT已经取得了显著的疗效。然而,当前的免疫疗法,特别是针对T淋巴细胞的疗法,在面对复杂的肿瘤微环境(TME)、T细胞耗竭等问题时,其效果和适用性仍面临挑战。
聚焦天然免疫:巨噬细胞与CD47靶点
天然免疫系统,特别是其中的巨噬细胞,正成为下一代免疫治疗的焦点。巨噬细胞具有快速反应、广泛识别肿瘤靶点等优势。癌细胞为了逃避巨噬细胞的吞噬,会高表达一种名为CD47的“别吃我”信号分子,该分子与其在巨噬细胞表面的受体SIRPα结合,从而抑制吞噬作用。因此,阻断CD47-SIRPα通路,解除这种免疫抑制,成为了一种有前景的抗癌策略。
然而,CD47广泛存在于正常细胞表面,传统的全身性抗CD47抗体疗法可能引发如溶血性贫血等严重副作用。此外,现有免疫检查点抑制剂(ICI)多为单克隆抗体,存在体内易清除、靶向性差、难以在肿瘤局部维持高浓度以及价格高昂等问题,限制了其广泛应用。

工程菌:肿瘤内的“抗体工厂”
为了克服上述挑战,华中科技大学的研究团队开发出一种创新的策略:利用经过基因改造的工程菌作为“活体药物工厂”,在肿瘤内部原位、持续地生产抗CD47抗体(aCD47)。
研究人员利用合成生物学技术,对一种减毒的大肠杆菌(E. coli MG1655)进行了改造。他们将编码aCD47的基因序列置于一个缺氧启动子(PfdhF)的控制之下。由于实体瘤内部通常处于缺氧状态,这种工程菌(称为缺氧反应细菌,HRB)在被注射到体内后,会特异性地聚集在肿瘤区域,并在缺氧的TME中被激活,开始生产并释放aCD47。
智能递送系统:增强疗效与安全性
为了进一步增强疗效,研究团队还设计了一种巧妙的递送系统。他们将能够招募并激活巨噬细胞的细胞因子(M-CSF)包裹在对TME响应的脂质体(LMs)中,并将这些脂质体“挂”在工程菌表面,构建成HRB@LM复合体。
当HRB@LM到达肿瘤后:
- 脂质体LMs响应肿瘤微环境中高浓度的谷胱甘肽(GSH),释放M-CSF,吸引并激活大量巨噬细胞浸润肿瘤。
- 工程菌HRB本身的外膜成分(LPS)也能刺激巨噬细胞向具有吞噬能力的M1型转化。
- 同时,HRB在缺氧环境下持续生产aCD47,阻断癌细胞的“别吃我”信号,促进M1型巨噬细胞识别并吞噬癌细胞。
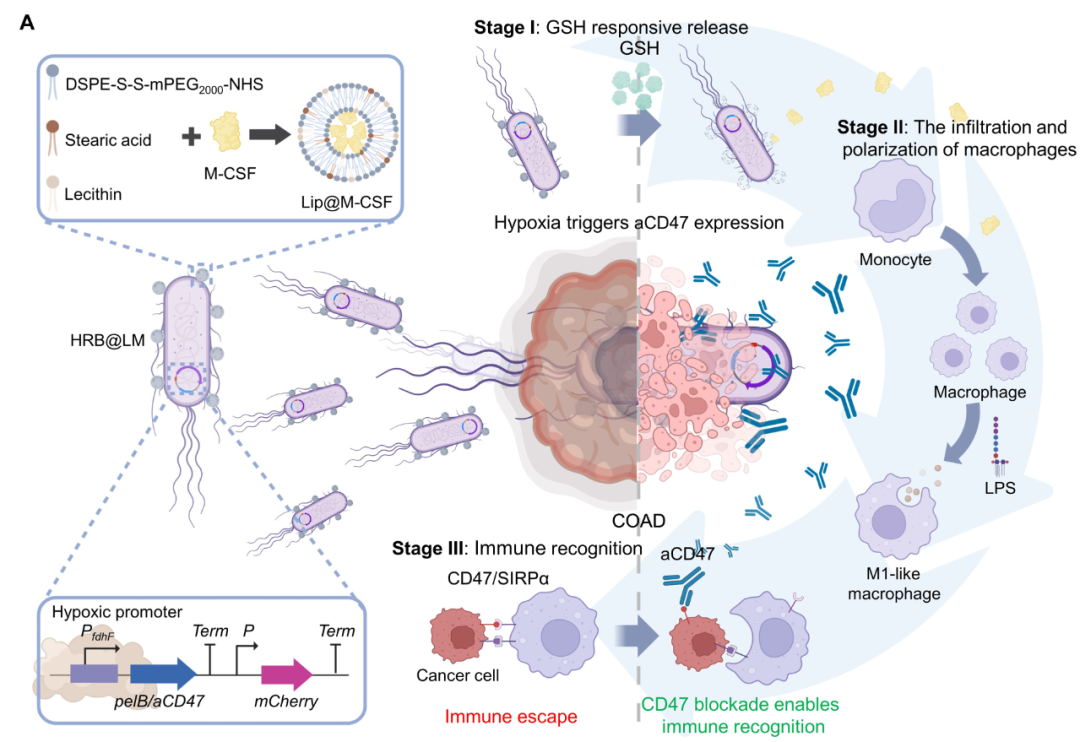
模式流程图(图片源自Science Advances)
研究成果与前景展望
这项发表在Science Advances上的研究表明,这种基于工程菌的智能系统(HRB@LM)在临床前模型中展现出显著的抗肿瘤效果:
- 精准靶向: 能够特异性地富集于肿瘤组织。
- 智能响应: 在肿瘤微环境中按需生产抗体和释放细胞因子。
- 协同增效: 有效激活巨噬细胞,增强吞噬作用,并进一步激活CD8+ T细胞,抑制远端肿瘤转移。
- 安全性高: 相比传统疗法,展现出更低的致病性和更好的肠道耐受性,甚至能调节肠道菌群平衡。
这种将工程菌改造为肿瘤内“抗体工厂”的策略,为开发更智能、更高效、副作用更低的肿瘤免疫治疗提供了全新的思路。它有望克服现有ICI疗法的部分局限,例如高昂的价格和全身性毒副作用。虽然这仍处于临床研究的早期阶段,但其展现出的巨大潜力预示着未来癌症治疗可能的新方向。
对于寻求前沿抗癌资讯和治疗选择的患者,了解这些新兴疗法至关重要。虽然工程菌疗法尚未上市,但持续关注免疫治疗、靶向药和仿制药的最新进展,有助于做出更明智的治疗决策。如需了解更多关于现有抗癌药物的信息,或希望探索可靠的海外购药渠道,可以访问MedFind药品信息库。对于复杂的治疗疑问,MedFind AI问诊或许能提供初步的解答方向,而MedFind抗癌资讯板块则汇集了更多前沿信息和诊疗指南。





