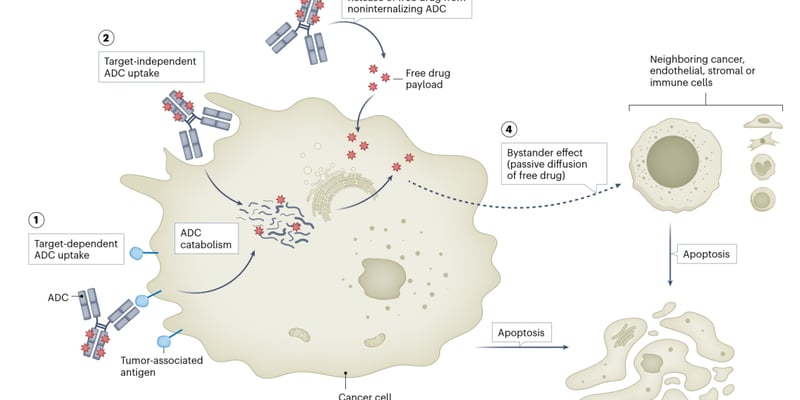
摘要
由美国生物制药公司ArriVent Biopharma研发的前沿药Furmonertinib获得美国食品药品监督管理局(FDA)授予的突破性疗法认证,用于具有EGFR 20号外显子插入突变的非小细胞肺癌患者。

关键信息如下:
美国食品药品监督管理局(FDA)授予前沿药Furmonertinib(AST2818)用于具有EGFR 20号外显子插入突变、先前未经治疗的、局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)患者的突破性疗法认证。
研究结果
初始治疗组的疾病控制率(即有效率)达到了100%,平均反应持续时间为15.2个月,蕞大肿瘤减少百分比的平均数为50.9%(表示有一半的患者治疗后肿瘤减小了至少50.9%)。
安全性