摘要
近日,美国FDA授予大名鼎鼎的前沿抗体偶连药物Enhertu两项突破性疗法认定,分别用于治疗HER2阳性的实体瘤患者以及HER2阳性的结直肠癌患者。

关键信息如下:
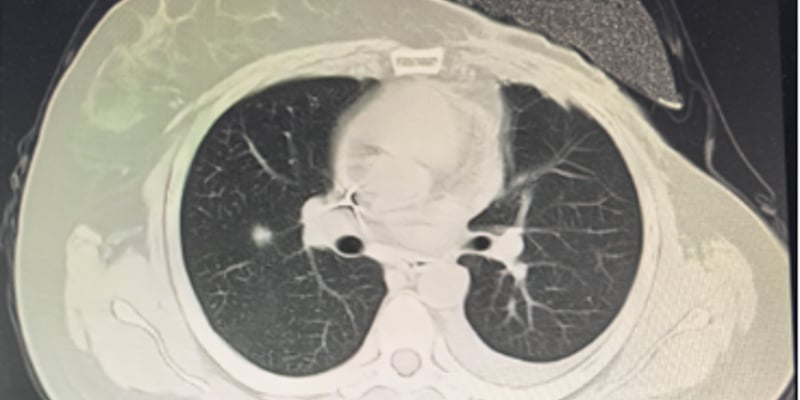
近日,美国食品药品监督管理局(FDA)授予Enhertu(DS-8201,德曲妥珠单抗)2项突破性疗法认定:其一是用于既往治疗后疾病进展且无满意替代治疗的不可切除或转移性HER2阳性实体瘤患者;其二是既往接受过至少2线治疗的HER2阳性转移性结直肠癌患者。这里的HER2阳性是指免疫组化结果为3+。
摘要
近日,美国FDA授予大名鼎鼎的前沿抗体偶连药物Enhertu两项突破性疗法认定,分别用于治疗HER2阳性的实体瘤患者以及HER2阳性的结直肠癌患者。

关键信息如下:
近日,美国食品药品监督管理局(FDA)授予Enhertu(DS-8201,德曲妥珠单抗)2项突破性疗法认定:其一是用于既往治疗后疾病进展且无满意替代治疗的不可切除或转移性HER2阳性实体瘤患者;其二是既往接受过至少2线治疗的HER2阳性转移性结直肠癌患者。这里的HER2阳性是指免疫组化结果为3+。