引言:探索更高效的癌症光动力疗法
光动力治疗(Photodynamic Therapy, PDT)作为一种精准、微创的癌症治疗方法,正受到越来越多的关注。其原理是利用特定波长的光激活“光敏剂”,产生活性氧(ROS)来杀死癌细胞。然而,如何提升光敏剂的效率和靶向性,一直是该领域的研究重点。近期,一项发表于国际顶尖期刊《Angewandte Chemie》的研究为解决这一难题提供了创新思路。
由内蒙古大学王建国教授团队领导的研究,提出了一种通过掺杂大体积氟化有机阴离子来构建高效光敏剂的新策略。这项技术有望显著增强光敏剂的荧光强度和细胞摄取效率,从而实现更强大的抗肿瘤效果。

创新策略:氟化阴离子如何增强光敏剂效能?
传统的光敏剂研究多集中于修饰其核心结构,过程复杂且普适性不强。该研究另辟蹊径,将目光投向了常被忽视的“阴离子”部分。研究人员通过将大体积的氟化有机阴离子(FTB)与一种具有聚集诱导发光(AIE)特性的光敏剂(DPBCF-Br)共同封装,制备出新型纳米颗粒,命名为 DF-FTBX。
这一设计的精妙之处在于:
- 提升发光效率:大体积阴离子能有效抑制分子间的过度聚集,减少能量损耗,从而大幅提高光敏剂的荧光强度。
- 促进细胞吸收:氟化有机阴离子增加了纳米颗粒的亲脂性,使其更容易穿透细胞膜,进入癌细胞内部。
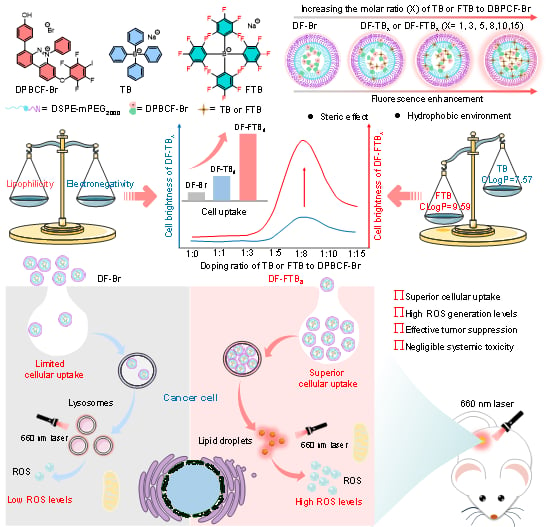
图1、通过改变大体积阴离子的比例调控NPs荧光强度和细胞摄取能力的设计思路。
关键研究发现:DF-FTB8的卓越表现
1. 光学性质与活性氧(ROS)生成能力
实验数据显示,随着氟化阴离子(FTB)比例的增加,纳米颗粒的荧光强度和活性氧生成能力均得到显著提升。当摩尔比达到8:1时,DF-FTB8 表现出最优的光学特性,为高效的光动力治疗奠定了基础。
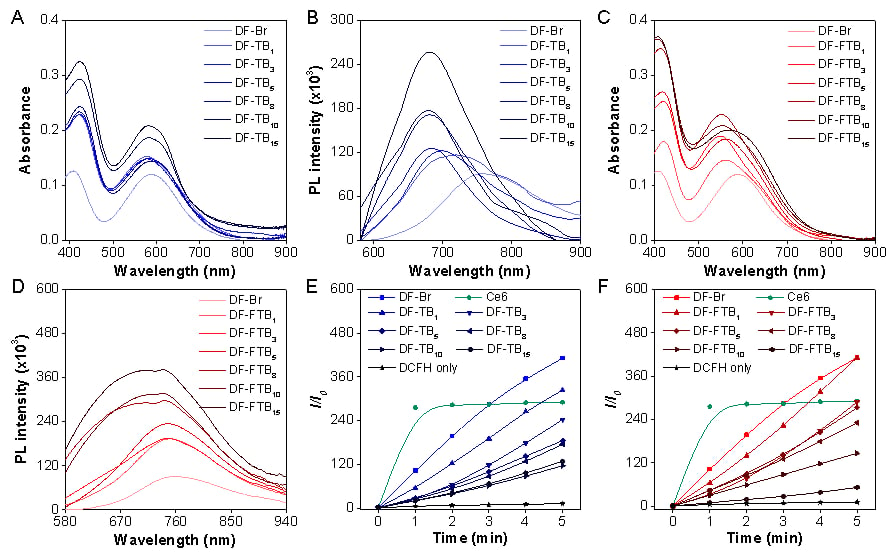
图2、DF-TBX与DF-FTBX的光学性质以及活性氧产生能力。
2. 细胞摄取与靶向能力
在针对HeLa(宫颈癌)细胞的实验中,研究人员发现,DF-FTB8 的细胞摄取量远超其他对照组。这是因为其优化的亲脂性与电负性达到了完美平衡。更有趣的是,该光敏剂能精准靶向细胞内的“脂滴”,这是一种理想的亚细胞器靶点,能进一步增强其光毒性。
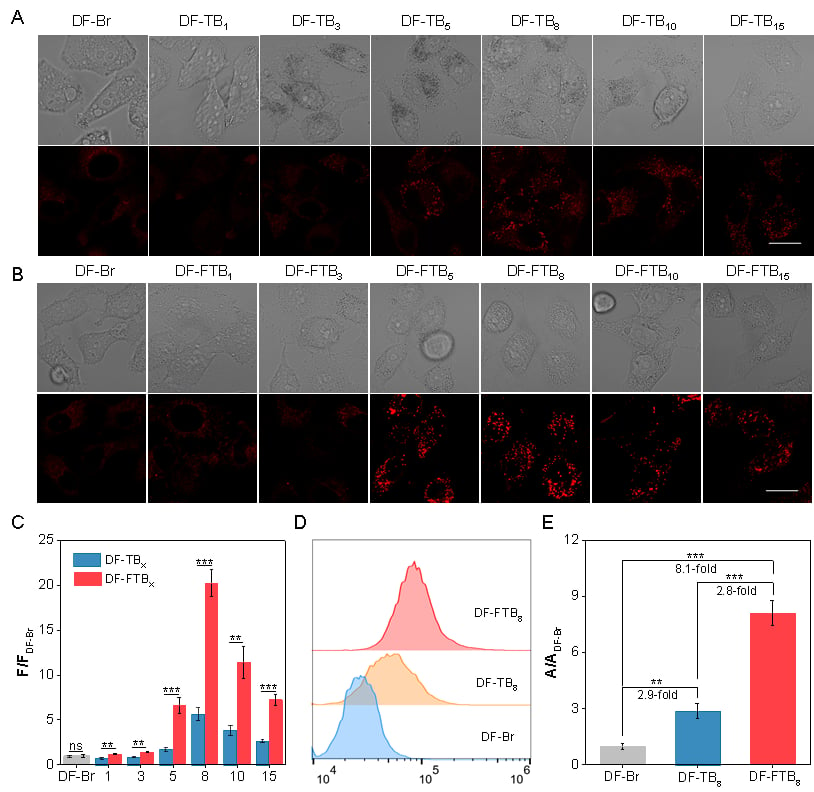
图3、DF-TBX与DF-FTBX在细胞内的成像以及摄取评估。
细胞毒性测试(MTT法)进一步证实,在光照条件下,DF-FTB8 对HeLa细胞展现出最强的杀伤效率,证明了其作为光动力治疗药物的巨大潜力。
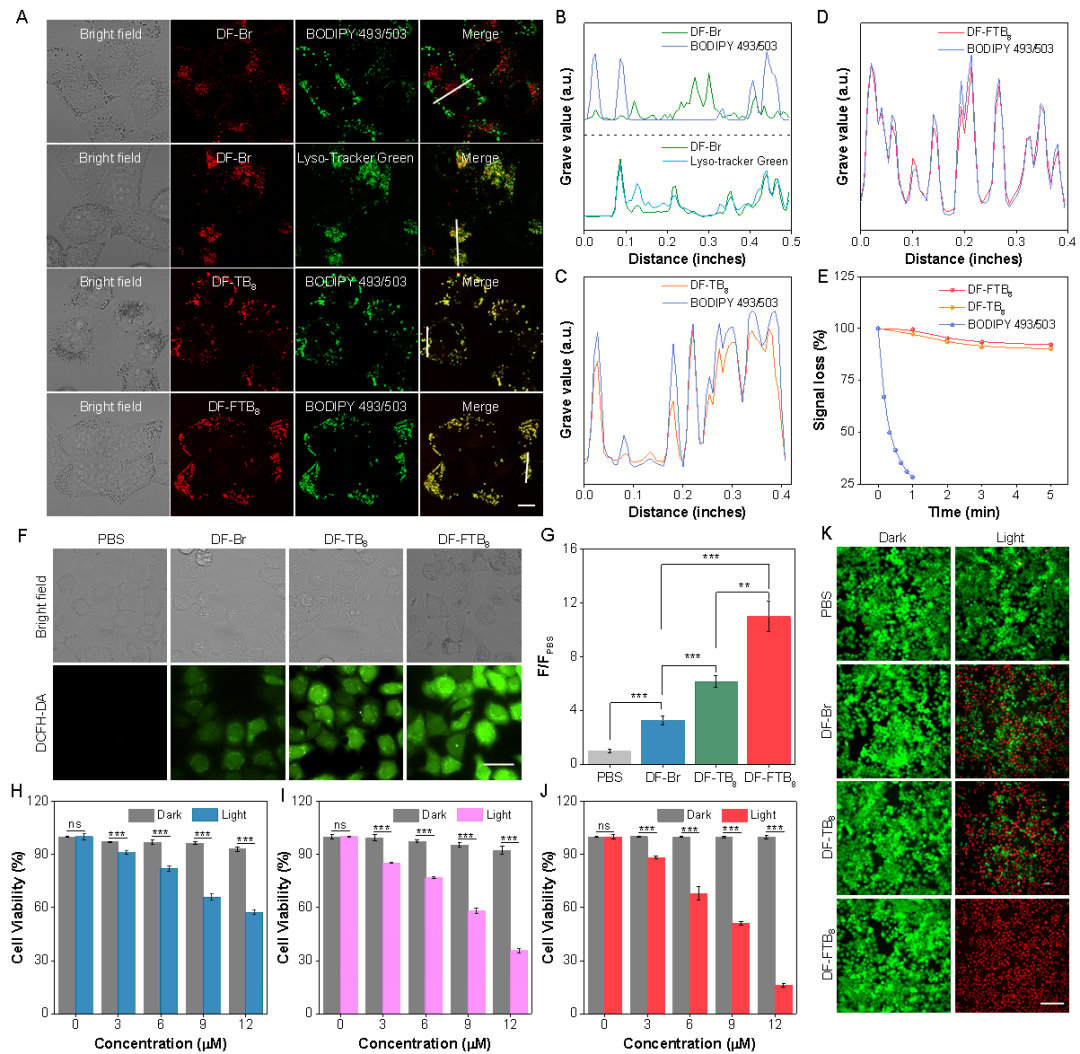
图4、DF-Br、DF-TB8与DF-FTB8在细胞内的共定位成像、ROS产生能力以及细胞毒性。
动物模型验证:高效抑制乳腺癌肿瘤生长
为了验证其在真实生物体内的疗效,研究团队构建了4T1乳腺癌小鼠模型。结果令人振奋:经静脉注射 DF-FTB8 并辅以660nm激光照射后,小鼠的肿瘤生长受到了显著抑制。更重要的是,整个治疗过程中,小鼠的体重和主要器官均未出现明显异常,显示出该新型光敏剂良好的生物相容性和低毒性,即潜在的副作用较小。
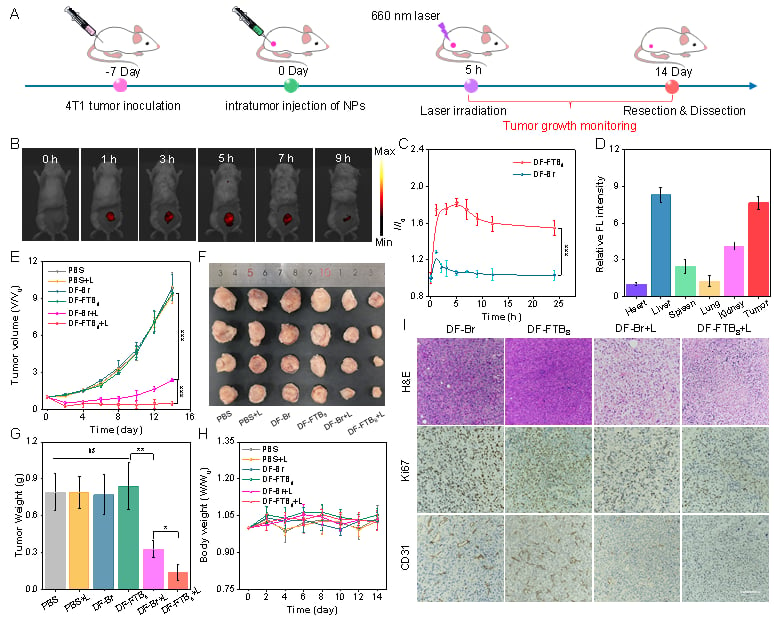
图5、DF-Br与DF-FTB8对4T1肿瘤的光动力疗效。
总结与展望
这项研究成功开发出一种简便而高效的策略,通过引入大体积氟化有机阴离子,显著提升了AIE型光敏剂的性能。DF-FTB8 作为其中的佼佼者,在细胞和动物实验中均展现了卓越的肿瘤成像和治疗效果。这一突破性进展不仅为设计更先进的光敏剂提供了新方向,也为乳腺癌、宫颈癌等多种癌症的光动力治疗带来了新的希望,有望在未来转化为更有效的临床治疗方案。