MYC家族基因,包括MYC(c-MYC)、MYCN和MYCL,在细胞的正常生长和发育中扮演着重要角色。它们的表达受到精密的调控。然而,在高达70%的人类恶性肿瘤中,MYC基因会出现异常高表达。这种异常通常与肿瘤的强侵袭性和不良预后密切相关。
作为一种关键的转录因子,MYC蛋白广泛参与调控细胞增殖、代谢、衰老、程序性细胞死亡(凋亡)以及血管生成等对肿瘤发生发展至关重要的生物学过程。此外,MYC还能帮助癌细胞逃避免疫系统的监控,并提高肿瘤对化疗药物的耐药性。鉴于MYC在癌症中的核心作用,它被认为是优化现有治疗策略和开发新型抗癌药物的极具潜力的靶点。
尽管MYC的重要性早已被认识,但由于其独特的结构和功能特性,直接靶向MYC蛋白一直被认为是极具挑战性的任务。近年来,随着对MYC作用机制理解的深入,科学家们正在积极探索多种创新的靶向治疗策略。
MYC蛋白结构与功能基础
MYC蛋白由多个结构域组成,其中C端区域对于与MAX蛋白形成异二聚体以及结合靶基因的启动子区域(特别是保守的E-box DNA序列CACGTG)至关重要。MYC必须与MAX结合形成异二聚体后,才能有效结合到DNA上,进而启动或抑制下游基因的转录,发挥其调控功能。理解MYC-MAX复合物的形成及其与DNA的相互作用,是开发靶向MYC治疗药物的关键切入点。
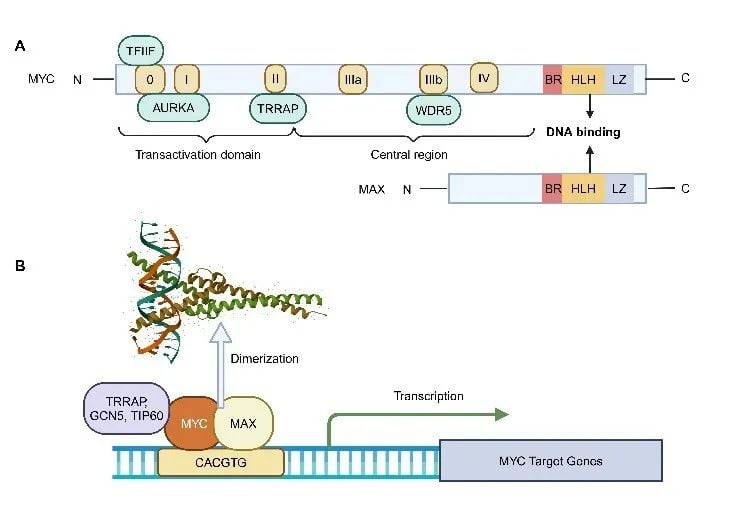
图1 MYC蛋白的结构与功能示意(图片来源:原文Figure 1)
癌症中MYC异常激活的多种途径
MYC在肿瘤中异常高表达并非单一原因造成,而是多种机制共同作用的结果。这些机制包括:
- 基因层面的改变:如MYC基因的扩增(拷贝数增加)、染色体易位(基因位置改变,靠近强启动子)或逆转录病毒插入等,直接导致MYC基因表达量增加。
- 表观遗传调控:超级增强子(Super-enhancers)的异常激活可以极大地增强MYC基因的转录。
- 细胞信号通路的失调:WNT、PI3K、ERK、Notch等多种重要的细胞信号通路在肿瘤中常常异常活跃,它们可以通过复杂的网络调控MYC的mRNA或蛋白水平,使其维持在较高水平。
- 蛋白质翻译后修饰:MYC蛋白本身的稳定性也受到调控,翻译后修饰(如磷酸化、泛素化)可以影响其降解速度,从而改变细胞内MYC蛋白的总量。
这些机制单独或协同作用,导致MYC在癌细胞中持续高水平表达,驱动肿瘤的发生和进展。
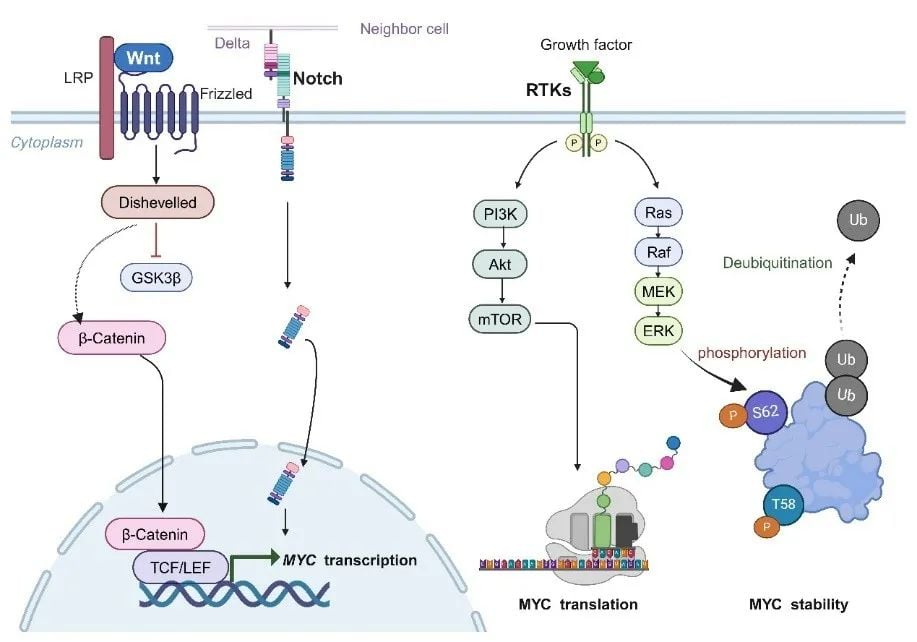
图2 调控MYC的多种信号通路(图片来源:原文Figure 2)
MYC在肿瘤发生发展中的关键作用
MYC癌蛋白通过调控下游众多靶基因的表达,几乎影响了癌细胞的所有关键行为。这包括促进细胞无限增殖、改变细胞代谢模式以满足快速生长的需求、抑制细胞衰老和凋亡、增强肿瘤细胞的转移能力、加速核糖体和蛋白质的生物合成等。此外,MYC还影响肿瘤微环境和免疫应答,帮助肿瘤逃避免疫系统的攻击。MYC的高表达还与肿瘤的耐药性以及癌症干细胞的维持密切相关。因此,精确解析MYC的功能和调控网络,对于实现癌症的精准医疗和优化治疗方案至关重要。
靶向MYC的治疗策略探索与进展
尽管MYC因其“天然无序区域”、缺乏药物结合口袋以及定位于细胞核内等特点,曾被认为是“不可成药”的靶点,但科学家们从未放弃努力。目前,针对MYC的治疗探索主要集中在以下几个方向:
1. 干扰MYC-MAX复合物的形成或功能:这是最直接的策略之一,旨在阻止MYC与MAX结合或阻止MYC-MAX复合物结合到DNA上。目前,小分子化合物正在开发中。值得关注的是,Omomyc(OMO-103)作为一种直接的MYC抑制剂,已进入临床I/II期试验,初步数据显示了其安全性和活性,为直接靶向MYC带来了希望。
2. 抑制MYC的转录或翻译:通过调控MYC基因的表达过程来降低MYC蛋白水平。这包括稳定MYC mRNA的G-四链体结构以阻碍转录,或靶向参与MYC转录调控的蛋白(如BRD4、CDK7、CDK9)以及参与MYC翻译的蛋白(如eIF4A)。
3. 促进MYC蛋白的降解:利用细胞自身的泛素-蛋白酶体系统(UPS)来加速MYC蛋白的清除。可以通过靶向调控MYC稳定性的蛋白(如PLK1、去泛素化酶DUBs)来实现间接抑制。此外,新型的蛋白降解技术,如蛋白降解靶向嵌合体(PROTAC),也正在积极探索用于降解MYC蛋白。
4. 利用合成致死效应:寻找与MYC异常高表达的癌细胞存在“合成致死”关系的基因。这意味着单独抑制MYC或该基因都不会杀死细胞,但同时抑制MYC和该基因,或仅抑制该基因(在MYC高表达背景下),就能特异性地杀死癌细胞。通过高通量筛选,已鉴定出CDK1、CHK1、ATR等多个潜在的合成致死伙伴基因,为联合治疗提供了新思路。
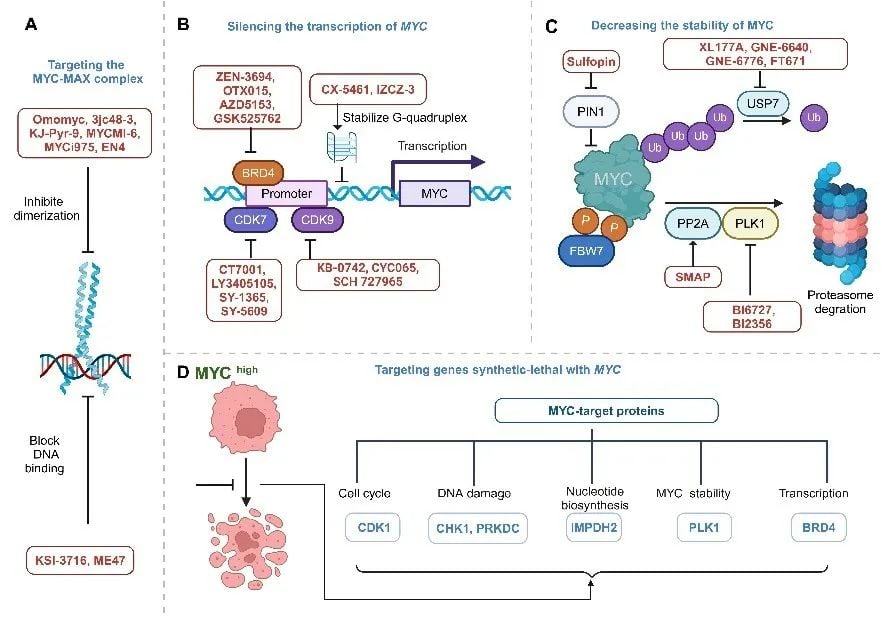
图3 靶向MYC的治疗策略概览(图片来源:原文Figure 4)
挑战与未来展望
尽管靶向MYC的治疗研发取得了显著进展,但仍面临诸多挑战。MYC在正常细胞中也发挥重要功能,因此靶向MYC可能带来脱靶副作用,例如在动物模型中观察到的早衰特征和代谢功能障碍。直接抑制剂的开发难度依然存在,而间接抑制策略可能只对特定肿瘤类型有效。此外,肿瘤的异质性和耐药性也是必须考虑的问题。
未来的癌症治疗趋势日益倾向于联合疗法,以克服单药耐药并提高疗效。针对MYC及其下游通路或合成致死伙伴的新型药物,有望与现有的化疗、靶向治疗或免疫疗法相结合。同时,通过患者分层(即根据患者肿瘤的具体分子特征选择最合适的治疗方案),将是提高MYC靶向治疗成功率的关键。
对于正在与癌症抗争的患者而言,了解这些前沿的靶向治疗研究进展至关重要。探索新的治疗方案,包括获取国内尚未上市的海外靶向药,或通过AI问诊获取个性化的诊疗建议,都可能为治疗带来新的希望。同时,持续关注权威的抗癌资讯,了解药物信息和诊疗指南,能帮助患者和家属做出更明智的决策。
总而言之,MYC作为一个在多种癌症中异常活跃的关键靶点,其复杂性带来了治疗挑战,但也蕴藏着巨大的潜力。随着研究的不断深入和新技术的应用,我们有理由相信,靶向MYC的治疗策略将在未来癌症治疗中发挥越来越重要的作用。





