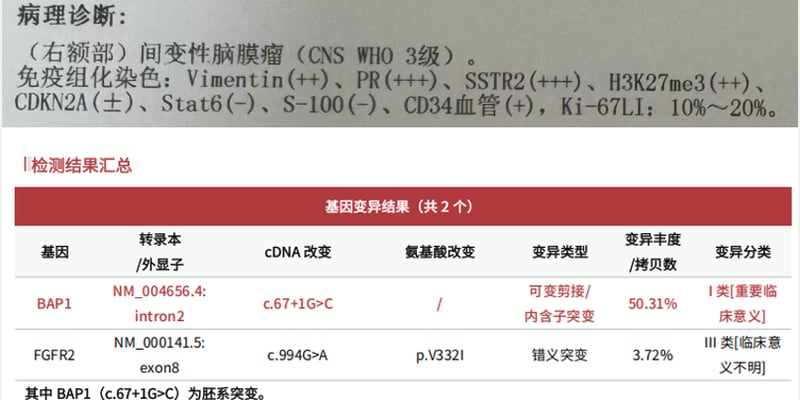
尤文肉瘤(Ewing sarcoma, EwS)是一种侵袭性强、多发于儿童和青少年的恶性肿瘤。长期以来,尤文肉瘤因其独特的生物学特性,特别是肿瘤细胞的免疫逃逸机制,被视为典型的“免疫冷肿瘤”。这类肿瘤抗原表达水平低,肿瘤微环境中存在免疫抑制因素,且缺乏足够的免疫细胞浸润,导致体内免疫系统难以有效识别和清除癌细胞。正因如此,目前基于免疫检查点抑制剂的单药治疗在尤文肉瘤中的效果并不理想。
探索尤文肉瘤免疫治疗的新策略
为了克服尤文肉瘤的免疫治疗困境,科学家们进行了不懈的探索。既往研究发现,提高尤文肉瘤组织中的干扰素γ水平,可以促进CXCL10和肿瘤浸润淋巴细胞(TILs)的增加,这与患者的生存获益相关。一些药物,如PEG-IFNα2,已被尝试用于诱导干扰素信号通路,并在其他肿瘤类型中与免疫检查点抑制剂联合应用。此外,溶瘤腺病毒(Oncolytic adenoviruses, OAds)作为一种能够诱导干扰素信号的常用工具,也引起了广泛关注。同时,越来越多的证据表明,CDK4/6抑制剂这类靶向药不仅影响细胞周期,还能激活多种抗肿瘤免疫效应。然而,这些单一疗法在临床上的效果仍然有限,迫切需要开发新的联合治疗策略,以期协同增效,克服尤文肉瘤免疫治疗面临的多重障碍。
溶瘤腺病毒联合CDK4/6抑制剂的潜力研究
近日,一项由德国科学家团队在著名期刊Clinical Cancer Research上发表的研究,为尤文肉瘤的治疗带来了新的希望。该研究题为“The oncolytic adenovirus XVir-N-31 joins forces with CDK4/6 inhibition augmenting innate and adaptive antitumor immunity in Ewing sarcoma”,深入探讨了利用YB-1驱动的溶瘤腺病毒XVir-N-31与CDK4/6抑制剂(如Ribociclib,即LEE011)联合应用的可能性。研究结果表明,这种联合疗法在动物模型中能够显著增强尤文肉瘤局部及系统性的抗肿瘤反应,展现出较高的临床应用潜力。

研究者首先在多种尤文肉瘤细胞系(A673、SK-N-MC、TC32)以及其他儿科肉瘤细胞系(如肺泡性横纹肌肉瘤RH41、双相性滑膜肉瘤SYO-1、骨肉瘤SJSA-1)中进行了体外评估。实验证实,溶瘤腺病毒XVir-N-31联合CDK4/6抑制剂确实能够增强肿瘤细胞的溶解效果并促进溶瘤病毒颗粒的生成。
进一步的小鼠模型实验验证了联合治疗在增强肿瘤细胞内病毒复制和肿瘤免疫原性方面的作用。联合治疗组的肿瘤细胞内病毒基因组数量增加,主要组织相容性复合体I类分子(MHC-I)表达水平显著上升,肿瘤抗原RB蛋白表达下降,同时肿瘤细胞表面抑制免疫识别的“别吃我”信号CD47的表达水平降低。值得注意的是,联合治疗组中的程序性死亡配体1(PD-L1)表达水平最高,这为后续联合PD-1/PD-L1抗体治疗提供了理论基础。
联合疗法激活抗肿瘤免疫反应
研究者还发现,联合治疗能够诱导人源T细胞在肿瘤中的浸润,并显著改善小鼠的生存状况。在A673异种移植瘤模型中,联合治疗组小鼠肿瘤及脾脏中的人源T细胞浸润显著增加,TC32模型中也观察到类似趋势。联合治疗组的小鼠生存时间明显优于各单药治疗组和对照组。对小鼠脾脏的分析显示,CD4⁺ T细胞显著扩增,且以T-bet⁺(TH1型)细胞为主,CD8⁺ T细胞也有上升趋势,表明联合治疗有效激活了适应性免疫反应。

该研究进一步探索了联合治疗是否能诱导远隔效应(Abscopal effect),即治疗一侧肿瘤后,另一侧未治疗的肿瘤也受到影响。实验结果令人鼓舞:联合治疗组中,未注射病毒的远端肿瘤生长明显受到抑制,肿瘤体积显著小于各单药治疗组和对照组。深入研究发现,在肿瘤微环境中,人源CXCL10水平在联合治疗组显著升高,而肿瘤浸润的人源T细胞表面CXCR3表达最高,这提示CXCL10/CXCR3轴可能在促进T细胞向肿瘤定向迁移中发挥了关键作用。

此外,研究者还发现联合治疗可以诱导肿瘤局部单核细胞浸润,并上调髓系细胞的MHC II表达。这包括单核细胞浸润增加,功能向抗原呈递细胞(APCs)极化和功能增强,以及M1/M2极化倾向。这些被激活的髓系细胞能够有效地促进肿瘤抗原特异性T细胞的增殖。
互增强免疫疗法(MRIAT)策略
总而言之,这项研究提出了一种新颖的联合治疗策略:互增强免疫疗法(MRIAT, Mutually Reinforcing Immune Activation Therapy)。该策略在体外和体内模型中均得到验证,能够成功增强尤文肉瘤中的溶瘤病毒复制、肿瘤免疫原性、局部及系统性免疫应答,最终实现显著的抗肿瘤效果。MRIAT策略与传统的单一溶瘤病毒治疗或单独应用CDK4/6抑制剂不同,其特点在于:
- 放大病毒复制,促进肿瘤细胞裂解:联合治疗导致更多肿瘤细胞裂解和新病毒颗粒生成。
- 促进固有免疫系统活化:联合治疗促进单核细胞向M1型极化,表现为高MHC II、CD80、CD86表达。
- 增强适应性免疫反应:肿瘤抗原特异性T细胞扩增增强,T细胞分泌干扰素γ能力提高。
- 诱导远隔效应:治疗一侧肿瘤后,未治疗侧的肿瘤也受益于免疫系统激活。
尽管本研究主要聚焦于尤文肉瘤,但考虑到其他高YB-1表达的肿瘤,如骨肉瘤、某些乳腺癌、胰腺癌等,也可能从这种联合治疗中获益。研究中观察到的PD-L1上调,也为未来将此联合疗法与PD-1/PD-L1抗体结合治疗尤文肉瘤提供了合理的理论基础。当然,文章也指出,后续还需要进一步确定最优剂量和给药时序,并设计更贴近临床的人源化小鼠模型或自体免疫系统保留的小鼠模型进行深入验证。
对于正在与癌症抗争的患者和家属而言,了解这些前沿的抗癌资讯和潜在新疗法至关重要。如果您对文中提及的靶向药、抗癌药或仿制药感兴趣,或希望了解更多关于海外购药的信息,可以访问MedFind网站。同时,面对复杂的病情和治疗方案,MedFind提供的AI问诊服务也能为您提供初步的参考和帮助。