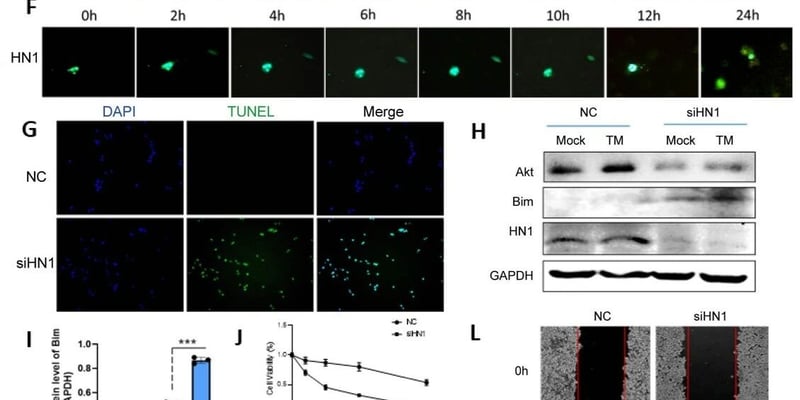
当孩子不幸被诊断出视网膜母细胞瘤,作为家长,您一定心急如焚,渴望了解最前沿的治疗方案和疾病信息。长期以来,医学界普遍认为这种儿童眼内恶性肿瘤主要由RB1基因的变异引起。然而,一项突破性的最新研究揭示了视网膜母细胞瘤基因组的复杂性远超我们的想象!这项全球最大规模的视网膜母细胞瘤全外显子测序(WES)研究,不仅再次确认了RB1基因的核心作用,更首次发现了许多“幕后推手”——其他关键基因的变异和染色体异常,它们对肿瘤的侵袭性、治疗选择乃至继发性肿瘤的风险有着至关重要的影响。这意味着,我们对这种疾病的理解正在进入一个全新的“多基因时代”,为患儿带来更精准的诊断、更有效的风险分层和更个性化的治疗方案。本文将为您深入解读这项研究的重大发现,帮助您全面了解视网膜母细胞瘤的基因秘密,为孩子的治疗之路点亮希望。
视网膜母细胞瘤:儿童眼癌的“基因密码”
视网膜母细胞瘤是儿童时期最常见的眼内恶性肿瘤,虽然罕见,但对家庭影响巨大。据统计,全球每年约有8000名患儿确诊。过去,科学家们主要关注一个名为RB1的抑癌基因。当这个基因的两个“拷贝”都失去功能时,就会引发肿瘤。这被称为“二次打击假说”,就像两扇门都需要被打开才能让疾病发生一样。RB1基因就像细胞周期的“刹车”,一旦失灵,细胞就会无限制地增殖,形成肿瘤。遗传性的视网膜母细胞瘤往往表现为双眼患病,发病年龄更小,这通常是因为孩子天生就带有一个RB1基因的缺陷,只需要后天再发生一次“打击”。而单眼患病则多是视网膜细胞在发育过程中偶然发生了两次RB1基因的变异。
为什么RB1基因不再是唯一的关注点?
尽管RB1基因是视网膜母细胞瘤的主要驱动因素,但它并不能解释所有病例的复杂性和多样性。大约1%到9%的肿瘤中存在MYCN癌基因的扩增,它能独立或协同RB1突变促使肿瘤生长。此外,还有许多其他基因变异、染色体拷贝数变异(CNA)和表观遗传修饰,都在肿瘤的发生发展中扮演着重要角色。这些“幕后推手”是什么?它们又是如何影响疾病进程的?为了全面揭示这些秘密,科学家们需要更深入、更大规模的研究。
史上最大规模研究:揭示视网膜母细胞瘤的“多基因图谱”
这项最新研究是迄今为止对视网膜母细胞瘤基因组特征分析样本量最大的队列,共对166名患儿的肿瘤样本及其配对的正常组织DNA进行了“全外显子测序”(WES)。WES是一种强大的基因检测技术,能够像“扫描仪”一样,精确读取基因组中所有编码蛋白质区域的DNA序列,从而发现各种基因变异。研究团队结合了变异检测、拷贝数变异(CNA)分析和整合分析等多种方法,旨在明确肿瘤的基因驱动因素及其与临床特征之间的关联。研究队列中,多数患儿为单侧病变,双侧病变患儿确诊年龄更小,这与我们对遗传性疾病的认知是一致的。

表1


图1
RB1基因变异:比想象中更复杂
研究首先对RB1基因的变异情况进行了深入分析。结果显示,大多数患者都符合“二次打击”模式,即两个RB1基因拷贝都受到了损伤。但研究还发现了一些此前未被充分认识的RB1变异,例如一种反复出现的良性内含子变异(c.2663+33C>T),其在研究人群中的频率远高于普通人群,这可能提示它作为非编码区调控因子或生物标志物发挥潜在作用。重要的是,研究证实RB1胚系变异(即从父母遗传下来的变异)与双侧视网膜母细胞瘤及发生第二原发癌的风险显著相关。这意味着,如果孩子携带RB1胚系变异,不仅双眼患病的可能性大增,未来发生其他类型癌症的风险也大大提高,其比值比(OR)高达19.69,这是一个非常高的风险提示。

表2




表3
RB1之外的“隐形杀手”:其他关键基因变异
研究人员并没有止步于RB1基因,而是继续探索其他可能影响视网膜母细胞瘤进程的基因。他们发现,除了RB1外,还有多种基因的变异反复出现,其中一些基因的发现具有重要的临床意义:
- MYCN基因扩增: 在6例患者中检测到MYCN基因的局部扩增。MYCN是一种重要的癌基因,它的扩增能独立或协同RB1突变促进肿瘤生长,在部分未发生RB1双等位基因失活的视网膜母细胞瘤中充当次级驱动因子。
- BCOR、CCND3、ERBB2和PDGFRB基因: 这些基因的变异在肿瘤中反复出现。其中,BCOR基因的变异被认为与不良预后相关。而ERBB2和PDGFRB基因的胚系变异尤为引人注目:
- ERBB2胚系变异: 与眼眶侵犯显著相关(OR=23.36)。这意味着携带ERBB2胚系变异的患儿,肿瘤更容易从眼球内扩散到眼眶,这提示了肿瘤的局部侵袭性更高。
- PDGFRB胚系变异: 与第二原发癌的发生显著相关(OR高达50.67!)。研究发现,携带PDGFRB胚系突变的患者,有更高的风险在未来患上白血病、嗅神经母细胞瘤等其他恶性肿瘤。这一发现强调了遗传易感性筛查和长期临床监测的重要性。PDGFRB基因编码一种调控细胞增殖和分化的受体酪氨酸激酶,其胚系变异已被证实与多种间叶源性肿瘤和血液系统肿瘤相关,现在又扩展到视网膜母细胞瘤患者的继发性肿瘤风险。
- MDM2和MDM4基因: 这两个基因是p53通路的负调控因子,在一些患者中也发现了突变,提示p53调控通路异常可能与RB1基因缺失协同作用,促进肿瘤发生。
- 错配修复基因变异: 研究中还检测到MSH2、MLH1、PMS2等错配修复基因的变异,在一些近亲婚配率较高的人群中,这可能与遗传易感性疾病——构成性错配修复缺陷综合征(CMMRD)有关,虽然本研究未获得明确的临床确诊证据。



染色体“异动”:拷贝数变异(CNA)的警示
除了基因层面的细微变异,染色体大片段的“拷贝数变异”(CNA)也对视网膜母细胞瘤的进展产生重要影响。研究发现,某些染色体区域的拷贝数增加与高风险的临床特征密切相关:
- 6p染色体拷贝数增加: 在41.3%的患者中发现,与虹膜新生血管、视网膜下种植及肿瘤突破筛板生长等高度侵袭性临床特征显著相关。这些都是预示肿瘤恶性程度高、治疗难度大的指标。
- 17q染色体拷贝数增加: 在8.1%的患者中发现,也与虹膜新生血管相关。
这些发现提示,染色体变异有望成为判断肿瘤高侵袭性表型的生物标志物,帮助医生更早地识别高风险患儿。
基因组分析如何重塑视网膜母细胞瘤的诊疗未来?
这项里程碑式的研究结果,对视网膜母细胞瘤的临床实践具有深远的指导意义:
- 优化风险分层: 通过全面分析患儿的基因组信息,医生可以更精确地判断肿瘤的侵袭性、复发风险和继发性肿瘤的风险。例如,通过检测ERBB2胚系变异,可以提前预警眼眶侵犯的风险;通过PDGFRB胚系变异,可以加强对继发性肿瘤的长期监测。
- 指导精准治疗: 了解肿瘤的独特基因组特征,有助于医生制定更个性化的治疗方案。虽然本文未直接提及特定药物,但深入的基因组理解是开发靶向治疗药物的基础,未来可能针对特定的基因变异开发出更有效的靶向药物,减少不必要的治疗干预,最大化治疗效果,最小化副作用。
- 改善长期预后: 借助基因组生物标志物进行早期预警和精准干预,有望显著提高患儿的生存率,并改善他们的长期生活质量。对于携带PDGFRB胚系变异的患儿,MedFind建议进行多学科的长期随访,包括常规临床评估、血液学监测及适龄影像学检查,特别是接受过放疗或烷化剂化疗的患儿,更需重点监测。
- 促进全球公平医疗: 本研究样本主要来源于中东及周边地区,为过去研究不足的人群提供了宝贵的基因组数据。MedFind坚信,整合全球多民族的基因组数据,是推动儿童肿瘤诊疗公平化的关键,确保不同背景的患儿都能受益于最新的精准医疗成果。
MedFind:与您同行,探索视网膜母细胞瘤的治疗之路
这项研究无疑为视网膜母细胞瘤的治疗带来了新的希望。它告诉我们,治疗不仅仅是切除肿瘤,更是要深入了解其背后的“基因密码”。通过先进的基因检测技术,我们可以为每一个患儿量身定制更精准的治疗和管理方案。MedFind平台致力于为癌症患者和家属提供最新抗癌资讯、药物信息,并协助构建海外购药渠道。如果您希望为孩子的视网膜母细胞瘤寻求更全面的基因检测与精准治疗方案,或需要了解更多前沿抗癌信息,我们的AI辅助问诊和专业团队随时为您服务。让我们一起,用科学的力量,为孩子的健康和未来努力。