对于任何一个家庭来说,儿童被诊断出癌症都是一个沉重的打击。在众多儿童癌症中,神经母细胞瘤和肾母细胞瘤是两种常见的胚胎性恶性肿瘤,它们来势汹汹,威胁着孩子幼小的生命。长期以来,虽然我们知道有些儿童癌症与遗传因素有关,但仍有许多家庭不清楚孩子患病的具体原因,这无疑加剧了他们的焦虑与无助。不过,最新的医学研究为我们带来了希望的曙光。
近期,一项发表在国际权威期刊EBioMedicine上的大规模基因组研究,首次明确证实了染色体2p24.3区域中包含MYCN基因的种系微重复,是儿童神经母细胞瘤和肾母细胞瘤一个确凿无疑的遗传易感因素。这项由英国多中心团队合作完成的研究,不仅厘清了长期悬而未决的基因责任归属问题,更为临床遗传咨询与肿瘤早期筛查提供了关键依据。这项里程碑式的发现,意味着我们离精准预防和早期干预儿童肿瘤又近了一步。
警惕儿童“隐形杀手”:神经母细胞瘤与肾母细胞瘤
神经母细胞瘤和肾母细胞瘤是儿童期最常见的两种实体肿瘤,它们都起源于胚胎期的未分化细胞,因此被称为“胚胎性肿瘤”。
- 神经母细胞瘤:起源于神经脊细胞,可以发生在身体的任何部位,但最常见于肾上腺或脊髓旁的神经节。它被称为“小儿癌症之王”,因为其恶性程度高,病情发展快,预后差异大,对儿童的健康构成巨大威胁。
- 肾母细胞瘤(又称Wilms瘤):是儿童最常见的肾脏恶性肿瘤,通常发生在5岁以下的儿童。虽然相比神经母细胞瘤,它的治疗效果通常较好,但如果发现不及时或治疗不规范,同样会危及生命。
尽管现代医学在儿童肿瘤的治疗上取得了长足进步,但早期诊断仍然是提高治愈率和改善预后的关键。然而,由于这些肿瘤早期症状不明显,加上儿童表达能力有限,很多时候发现时病情已进展到晚期,治疗难度大大增加。
一直以来,医学界已经识别出一些与家族性神经母细胞瘤(如ALK、PHOX2B基因变异)或肾母细胞瘤(如WT1基因变异)相关的遗传基因。但令人困惑的是,仍有相当比例的患儿家庭,尽管有家族史或发病特点,却找不到明确的遗传病因。这就像一个巨大的谜团,让无数家庭在痛苦中摸索,而MYCN基因的体细胞扩增或增益,虽然是这两种肿瘤常见的驱动事件,但它与遗传风险之间的具体关联,此前一直未能完全解明。

重磅突破:MYCN基因微重复,明确儿童肿瘤新遗传信号
为了解开这个遗传之谜,英国多中心研究团队展开了一项大规模的基因组研究。他们系统性地挖掘了英国国家基因组研究库中多达113,431个全基因组数据,开发了专门的分析流程,旨在精准筛选染色体2p24.3区域的拷贝数增益。
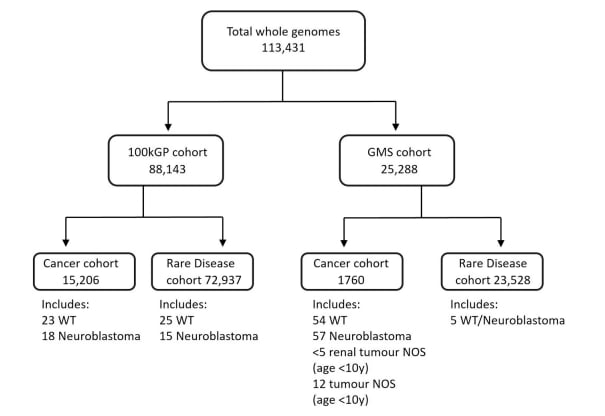
图:研究纳入流程图
这项研究的发现令人振奋:
- 罕见但高风险:在超过11万名参与者中,仅发现了6人携带包含MYCN位点的微重复,这表明这种遗传变异在普通人群中极其罕见(频率约为3/113,234)。
- 显著相关性:然而,在这6名携带者中,有3人罹患了目标肿瘤(2例肾母细胞瘤,其中1例为双侧;1例神经母细胞瘤)。通过严谨的统计分析发现,这种微重复在肿瘤患者中的出现频率显著高于无病史人群(3/197 vs. 3/113,234, p < 0.0001)。这有力地证明了MYCN基因微重复与儿童肿瘤之间的明确关联。
- 中等外显率:基于贝叶斯公式估算,这种种系变异导致儿童期发生神经母细胞瘤或肾母细胞瘤的外显率约为13%(95% CI: 2%–60%)。所谓“外显率”,就是指携带特定基因变异的人群中,最终表现出疾病的比例。13%属于中等渗透率,这意味着携带该基因变异的个体并非100%会发病,但其风险显著高于普通人群,与许多其他已知儿童肿瘤易感基因的风险水平相当。
这项研究首次明确地量化了MYCN基因种系微重复作为儿童肿瘤遗传风险因素的地位,为患儿家庭和临床医生提供了重要的遗传学依据。
解密致病机制:MYCN而非DDX1,兼具“剂量效应”与“结构倾向”
过去,病例报告曾提示包含MYCN和邻近DDX1基因的2p24.3种系重复可能与发病相关。但由于这两个基因总是共同出现,医学界一直无法区分究竟是MYCN、DDX1,还是两者共同导致了肿瘤易感性,这给遗传检测带来了困扰。

图:a–c:IGV图像显示了与生殖系2p24.3微重复(包含MYCN基因)相关的各肿瘤样本的生殖系和体细胞测序覆盖度及比对情况。d:UCSC基因组浏览器图像,展示了所有携带包含MYCN和/或DDX1基因的2p24.3重复的受试者
这项研究最突破性的发现之一,在于成功地将MYCN与DDX1的致病角色清晰地分离。研究人员同时识别出12名携带仅包含DDX1(不包含MYCN)微重复的个体,令人惊讶的是,其中无一人患有儿童胚胎性肿瘤。这一确凿的证据终结了长期的猜测,明确证明了儿童肿瘤的遗传易感性特异性地源于MYCN基因的额外拷贝,而非DDX1。这一发现对于未来的遗传检测和风险评估具有极其重要的指导意义,它指明了临床检测的靶点。
MYCN基因:肿瘤发生的“双重推手”
研究人员进一步深入分析了致病机制,他们对三名患病携带者的肿瘤样本进行测序,发现其体细胞中MYCN的异常(增益或扩增)的基因组断点,与其种系重复的断点完全一致。这强烈暗示了MYCN基因在肿瘤发生中扮演的“双重推手”角色:
- “剂量效应”:MYCN是一个重要的原癌基因,正常情况下参与细胞生长和分化的调控。当它多了一个拷贝(微重复)时,就好比细胞内MYCN基因的“信号强度”增加了,这会轻微地扰乱细胞的正常生长调控,增加患癌风险。
- “结构倾向”:更深层的原因是,预先存在的种系重复在染色体结构上创造了一个“脆弱点”。这个脆弱点就像一个更容易断裂或重组的位置,可能通过非等位基因同源重组等机制,极大地促进了MYCN在肿瘤发生过程中进一步的、更大范围的体细胞扩增。这种“结构倾向”为肿瘤的快速发展提供了生物学基础。
这不仅仅是MYCN基因“多一个拷贝”这么简单,更是一种“结构性缺陷”,为后续肿瘤的爆发式生长铺平了道路。这项机制上的发现,为我们理解儿童肿瘤的发生发展提供了全新的视角。
对患者家庭意味着什么?遗传咨询、精准筛查与早期干预
这项研究的意义远不止于学术层面,它对无数儿童肿瘤患儿家庭以及高风险家庭来说,是实实在在的希望与行动指南。
谁需要考虑基因检测?
对于那些曾被告知孩子患病“原因不明”的家庭,这项研究可能为他们提供了一个明确的答案。虽然MYCN基因微重复的携带者并非100%会发病,但其较高的外显率意味着它是一个不容忽视的风险因素。
以下几类家庭或个体,应更积极地考虑进行MYCN基因微重复的检测,并寻求专业的遗传咨询:
- 有儿童神经母细胞瘤或肾母细胞瘤家族史的家庭。
- 同一家庭中出现多例儿童肿瘤患者的情况。
- 患儿存在双侧肾母细胞瘤或其他特定临床特征。
- 此前已进行过常规基因检测,但仍未能找到明确致病基因的患儿家庭。
- 对于已发现MYCN微重复的家庭,其成员尤其是育龄期的父母和兄弟姐妹,也应考虑进行遗传咨询和检测,以评估未来的生育风险和后代患病风险。
专业的遗传咨询师可以帮助家庭理解检测结果的意义,评估个体风险,并提供个性化的建议。这不仅仅是诊断,更是对家庭未来健康的规划。
遗传风险评估与早期筛查的重要性
既然我们明确了MYCN基因微重复是儿童神经母细胞瘤和肾母细胞瘤的一个遗传风险因素,那么“早发现、早干预”就变得尤为重要。对于携带这种基因变异的儿童,定期进行针对性的早期筛查,能够显著提高肿瘤的发现率,从而获得更好的治疗效果和生存预后。
早期筛查可能包括:
- 定期影像学检查:如超声波、MRI等,对高危儿童的肾脏和腹部进行定期监测。
- 血液或尿液生化指标检测:某些肿瘤可能会引起特定的生物标志物升高,通过定期检测这些指标,有助于早期发现异常。
请注意,具体的筛查方案需要由专业的儿科肿瘤医生或遗传咨询专家根据孩子的具体情况制定,切勿盲目自行检查。
MedFind:您身边的抗癌智慧伙伴
面对复杂的医学信息和个人化的治疗需求,患者家庭常常感到迷茫。MedFind作为一个由癌症患者家属发起的平台,深知这种痛苦与无助。我们致力于分享最新、最准确的抗癌资讯和药物信息,并提供多元化的支持服务,包括:
- 专业抗癌资讯:如本文一样,我们将晦涩难懂的医学研究转化为通俗易懂的科普文章,帮助您了解疾病的最新进展。
- AI辅助问诊:通过智能科技,为您提供个性化的初步咨询,解答您的疑惑。
- 全球药品获取渠道:对于国内尚未上市或难以获取的创新抗癌药物,MedFind可以协助您构建海外购药渠道,确保您能及时获得所需的治疗。
在儿童肿瘤这样需要长期、多方面支持的领域,MedFind将始终与您同行,提供可靠的信息与温暖的陪伴。
展望未来:儿童肿瘤精准预防新篇章
这项关于MYCN基因微重复的研究,无疑为儿童神经母细胞瘤和肾母细胞瘤的精准预防和早期干预打开了新的篇章。它不仅为众多此前病因不明的患儿家庭提供了答案,更将推动临床遗传检测实践的更新,使得我们能够更早地识别高风险儿童,实施有效的干预措施,从而减少儿童因这些恶性肿瘤带来的痛苦。
随着基因测序技术的不断进步和医学研究的深入,我们有理由相信,未来会有更多像MedFind这样的平台和机构,能够提供更精准的风险评估、更便捷的基因检测以及更全面的治疗方案。科学的进步永不止步,它将为每个受儿童肿瘤困扰的家庭,带来更多光明与希望。





