亲爱的患者朋友和家属们,您是否正在为癌症治疗的复杂性而感到焦虑?是否渴望了解最新的抗癌科技,为自己或家人寻找更多希望?在与癌症抗争的漫长旅程中,免疫治疗无疑是近年来最令人振奋的突破之一。它通过调动我们自身的免疫系统来识别并清除癌细胞,为许多患者带来了新的生机。今天,我们将深入探讨免疫治疗领域一个备受瞩目的“新星”——cGAS-STING通路。这个听起来有些复杂的生物学概念,实际上是我们身体内一套精密的“细胞警报系统”,它在抗击癌症中扮演着至关重要的角色。了解它,或许能帮助您更好地理解未来的治疗方向和选择。
最近,《Nature Reviews Cancer》期刊于2026年1月5日发表了一篇重磅综述文章,系统阐述了cGAS-STING通路在肿瘤进展中的“双面角色”:它既能启动免疫监视,促进抗肿瘤免疫,又可能在慢性激活下反而推动癌症进展和转移。文章还深入剖析了当前STING激动剂在临床转化中面临的困境,并展望了未来如何通过优化策略,提升癌症免疫治疗的应答率。MedFind致力于为您提供最前沿的抗癌资讯和药物信息,帮助您构建海外购药渠道,并提供AI辅助问诊服务,让您在抗癌路上不再孤单。
癌症免疫治疗的“新星”:cGAS-STING通路是什么?
要理解cGAS-STING通路,我们可以把它想象成我们细胞内部的一套“DNA警报系统”。我们都知道,细胞的DNA(基因组)通常被严密地保护在细胞核内,而线粒体也有自己的DNA。当这些DNA因为各种原因(比如细胞损伤、癌变、感染等)错误地出现在细胞质中,或者在细胞核内异常积累时,身体就会将其视为“危险信号”。
- cGAS:DNA的“侦察兵”:当细胞质中出现异常的双链DNA(dsDNA)时,一种名为cGAS的蛋白质会立刻“侦察”到它。cGAS就像一个高度敏感的传感器,一旦发现这些“不速之客”,就会被激活。
- STING:警报的“放大器”:被激活的cGAS会催化生成一种特殊的“信使分子”——环状二核苷酸2‘3’-cGAMP。这个信使分子会进一步激活内质网上的STING蛋白。STING就像一个警报的“放大器”和“中转站”,它被激活后会迅速移动到高尔基体,并招募其他关键蛋白,如TBK1和IRF3。
- I型干扰素与免疫反应:免疫大军的“集结号”:最终,这一系列激活反应会驱动身体产生大量的I型干扰素(IFN-I)以及其他促炎因子。I型干扰素就像是免疫大军的“集结号”,它能迅速调动各种免疫细胞(如T细胞、自然杀伤细胞、树突状细胞等)前来识别并攻击癌细胞,从而启动强大的抗肿瘤免疫反应。
简而言之,cGAS-STING通路就是细胞通过感知异常DNA,发出警报,从而召集免疫系统来清除潜在威胁(包括癌细胞)的一条关键路径。这条通路广泛存在于我们身体的各种细胞中,参与调控着细胞衰老、固有免疫(身体的第一道防线)、细胞死亡等重要过程,深刻影响着肿瘤微环境(TME)的形成和发展。
cGAS-STING通路在癌症中的“双面人生”:抗癌与促癌
cGAS-STING通路在癌症中的作用并非一成不变,它像一把双刃剑,既能成为抗癌的利器,也可能在特定情况下“帮倒忙”,促进肿瘤的进展。理解它的“双面人生”,对于我们精准地利用它来治疗癌症至关重要。
抗癌的“光明面”:如何帮助身体对抗肿瘤?
在许多情况下,cGAS-STING通路是身体对抗癌症的重要防线。它的激活可以触发多种抑癌机制,包括细胞衰老、细胞死亡以及强大的免疫监视。
1. 肿瘤起始阶段的“守护者”
- 诱导细胞衰老与死亡:肿瘤的发生需要突破细胞衰老和复制危机这两大屏障。当DNA受损时,cGAS-STING通路会被激活,促使受损细胞进入衰老状态或直接死亡,从而阻止它们癌变。在一些肝癌和乳腺癌模型中,研究发现cGAS-STING通路就像一道“最后屏障”,通过触发细胞自噬或坏死性凋亡,阻止癌细胞的形成。
2. 招募免疫大军,精准打击癌细胞
- 激活T细胞免疫:当肿瘤形成后,宿主(特别是树突状细胞,DC)的STING信号对于启动抗肿瘤T细胞反应至关重要。树突状细胞能够捕获肿瘤细胞释放的DNA,激活自身的cGAS-STING通路,进而“教育”和激活T细胞,使其能够识别并攻击癌细胞。
- 增强免疫检查点抑制剂(ICB)疗效:在一些DNA错配修复缺陷(MMR缺陷)的癌症中,癌细胞内异常DNA的积累会激活cGAS-STING通路,促进CD8+ T细胞(重要的“杀手”T细胞)浸润到肿瘤内部,从而显著增强免疫检查点抑制剂(如PD-1/PD-L1抑制剂)的治疗效果。
3. 与现有疗法协同作战,放大抗癌效应
- 放疗和化疗的“免疫帮手”:传统的放疗和化疗通过损伤癌细胞DNA来杀死它们。这个过程会进一步增加胞质DNA的积累,从而激活cGAS-STING通路。研究表明,这种激活能够诱导I型干扰素的产生,进而增强免疫系统对肿瘤的识别和清除能力,使治疗效果更好。
- PARP抑制剂的“免疫加成”:PARP抑制剂是一类靶向DNA损伤修复的药物。它们在杀死癌细胞的同时,也会促进胞质DNA的积累,激活cGAS-STING通路,从而增强T细胞浸润,并与免疫检查点抑制剂产生协同作用,进一步提升疗效。
- 肿瘤治疗电场(TTFields):这种新型疗法通过破坏癌细胞的有丝分裂纺锤体,诱导微核破裂和DNA释放,也能以cGAS-STING依赖的方式激活树突状细胞和T细胞,发挥抗肿瘤作用。
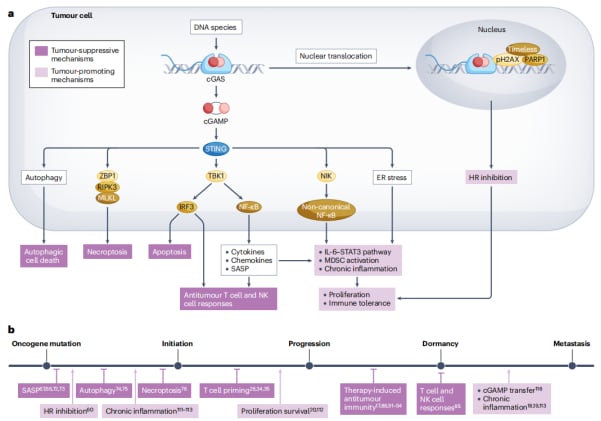
图2 cGAS-STING通路激活在肿瘤进展不同阶段的癌细胞中具有双重作用。
促癌的“阴暗面”:为何有时会“帮倒忙”?
然而,cGAS-STING通路并非总是扮演“好人”的角色。在某些情况下,特别是当它被慢性或异常激活时,反而可能促进肿瘤的进展,甚至导致治疗抵抗。
1. 慢性炎症的“推手”,助长肿瘤生长与转移
- 炎症与癌症的恶性循环:慢性炎症是公认的癌症驱动因素之一。当cGAS-STING通路长期处于低水平激活状态时,它可能不再主要产生抗癌的I型干扰素,而是转而产生大量促炎因子,从而在肿瘤微环境中形成一种有利于癌细胞生长、增殖和转移的炎症环境。
- 促进肿瘤转移:研究发现,染色体不稳定性(CIN)高的癌细胞转移能力更强,这往往依赖于cGAS-STING通路诱导的非经典NF-κB信号。这种信号与乳腺癌患者的较差预后相关。在胰腺癌中,慢性激活的cGAS-STING通路甚至可以通过激活NF-κB和STAT3信号来驱动肿瘤转移。
2. 肿瘤细胞内在的“帮凶”
- 核cGAS的非经典功能:除了在细胞质中感知DNA并激活免疫反应外,cGAS在细胞核内还有一些“非经典”的功能。例如,当DNA受损时,核cGAS可以参与DNA修复,甚至在某些情况下,它的存在反而会促进癌细胞的增殖,并可能影响癌细胞对放化疗的敏感性。这些作用大多不依赖STING,也与免疫反应无关。
STING激动剂:充满希望的抗癌新药,为何临床屡屡受挫?
鉴于cGAS-STING通路在抗肿瘤免疫中的关键作用,科学家们自然而然地想到开发能够“激活”STING的药物,即STING激动剂,以期唤醒患者自身的免疫系统来对抗癌症。在临床前研究中,STING激动剂展现出了令人鼓舞的抗肿瘤效果,例如在黑色素瘤、结肠癌、乳腺癌等多种小鼠肿瘤模型中,瘤内注射合成STING激动剂能够诱导肿瘤快速消退,并产生持久的全身性T细胞记忆,甚至与免疫检查点抑制剂联用还能增强疗效。这些积极的结果推动了多种STING激动剂进入临床试验。
临床试验的困境与挑战
然而,尽管临床前研究前景广阔,STING激动剂在临床试验中的表现却不尽如人意。目前,虽然有约15种STING激动剂进入临床试验,但大多数结果并不理想。
- 早期失败案例:例如,早期的激动剂DMXAA因为只能激活小鼠的STING而无法在人体中发挥作用,最终临床失败。
- 疗效有限与半衰期短:首个进入临床的人源环状二核苷酸激动剂ADU-S100,在I期试验中疗效有限,仅有一例患者获得部分缓解,且其在体内的半衰期非常短(约24分钟),导致药效难以持久。后续与抗PD1药物联合的试验也因活性不足而终止。另一个激动剂MK-1454作为单药治疗无效,联合治疗的反应也十分有限。
截至目前,尚未有STING激动剂展现出强效的临床活性,这让许多人对这一领域的未来产生了疑问。那么,究竟是什么原因导致了这些临床失败呢?
临床失败的可能原因深度解析
科学家们正在积极探索STING激动剂临床转化受挫的深层原因,主要包括以下几点:
- 局部给药的局限性:目前大多数STING激动剂采用瘤内注射的方式,可能只引起局部短暂的免疫激活,难以产生有效的全身性抗肿瘤反应。
- 剂量与毒性的平衡难题:过高的剂量可能导致T细胞和树突状细胞(DC)的死亡,反而损害持久的免疫功能,产生脱靶毒性。
- STING通路功能受损:许多人类肿瘤中,STING-TBK1-IRF3-IFN轴的功能本身就存在缺陷或被抑制,导致药物难以发挥作用。
- 促癌信号的干扰:在某些情况下,STING通路介导的促癌信号(如非经典NF-κB信号)可能压倒其抑癌功能,使得药物效果适得其反。
- 患者选择的精准性不足:并非所有肿瘤都适合STING激动剂治疗。患者的肿瘤突变负荷(TMB)和肿瘤抗原性等因素可能影响疗效,但目前的临床试验可能未能充分考虑这些个体差异。
- 临床前模型的局限性:小鼠皮下移植瘤模型无法完全模拟人类自发性、原位肿瘤的复杂性,导致在动物身上有效的药物在人体内表现不佳。
- 药物在肿瘤微环境中的稳定性与滞留:小分子药物在复杂的肿瘤微环境中可能难以持久滞留,影响其药效。
限制cGAS-STING通路激活的“幕后黑手”:为何它不总是有效?
cGAS-STING通路虽然强大,但它受到身体内多种精密机制的严格调控。这些“幕后黑手”的存在,部分解释了STING激动剂为何疗效不佳,也为我们未来的治疗策略提供了新的思路。
1. STING激活受损:警报系统“失灵”
- cGAS接触DNA受限:cGAS作为“侦察兵”,并非总能接触到异常DNA。它可能被核小体束缚,或被其他蛋白拮抗,甚至被降解,导致无法有效感知危险信号。
- 树突状细胞(DC)摄取DNA受损:树突状细胞是启动免疫反应的关键。然而,肿瘤细胞表面的某些分子(如CD47)可以与DC表面的受体结合,抑制DC摄取肿瘤DNA,并促进DNA降解,从而阻碍cGAS-STING通路的激活。
- 基因表达被“关闭”:在许多癌细胞中,cGAS和STING基因的表达可能因启动子甲基化等表观遗传学改变而被“关闭”,导致通路无法正常工作。
- 代谢环境的干扰:肿瘤微环境中的高胆固醇水平会抑制STING从内质网向高尔基体的转运,阻碍其激活。高乳酸水平也可能通过多种方式抑制cGAS的活性。
2. 负调控机制:身体的“刹车”系统
为了防止免疫反应过度,身体也存在一系列负反馈机制来“踩刹车”:
- 自噬与降解:激活的cGAS可以诱导自噬,清除胞质DNA并降解STING蛋白,从而限制信号的持续时间。
- 酶的降解作用:一些酶(如TREX1、ENPP1)能够降解胞质DNA或cGAMP信使分子,从而削弱cGAS-STING通路的信号。
3. 免疫细胞“疲劳”或“变节”:抗癌大军“叛变”
- 固有免疫细胞的耐受性:慢性激活的STING通路可能导致固有免疫细胞(如B细胞、髓源性抑制细胞,MDSCs)分泌抑制性因子(如IL-35),从而抑制NK细胞功能,甚至促进MDSCs的募集,导致放疗抵抗。
- T细胞的功能受损:在CD8+ T细胞中,适度的cGAS-STING信号有助于维持其干细胞样特性,但如果与TCR信号同时过度激活,反而会严重损害T细胞功能,导致其凋亡增加、增殖和代谢受损。
- 调节性T细胞的分化:STING激活还可能促进CD4+ T细胞分化为调节性T细胞(Treg),而Treg是免疫抑制细胞,会抑制抗肿瘤免疫反应。
4. STING的“额外功能”与免疫细胞死亡
研究发现,STING蛋白本身还具有质子通道功能。这种功能对于其激动剂诱导的非经典自噬、NLRP3炎性体激活以及某些免疫细胞的死亡至关重要。这意味着,STING激动剂在激活免疫反应的同时,也可能通过其质子通道功能导致有害的细胞死亡,从而削弱治疗效果。
5. 肿瘤背景与免疫原性:因“瘤”而异
STING激动剂的抗肿瘤机制和疗效可能因肿瘤类型、模型以及剂量而异。肿瘤的“个性”——即其抗原性(能否被免疫系统识别)——是决定cGAS-STING介导免疫监视效果的关键。在一些高突变负荷(TMB)的肿瘤中,cGAS高表达与较好预后相关,提示新抗原在优化该通路免疫中起核心作用。但在低抗原性肿瘤中,宿主STING激活反而可能抑制T细胞浸润并促进肿瘤生长。
展望未来:如何驾驭cGAS-STING,开启抗癌新篇章?
面对cGAS-STING通路复杂的双重作用和临床转化的挑战,科学家们并未放弃。未来的研究将更加注重精准的情境依赖性调控,力求“扬长避短”,将这一通路转化为有效的抗癌武器。
1. 改善激动策略:让“警报”更精准、更持久
- 选择性诱导DNA释放:研究人员正在探索如何选择性地诱导线粒体DNA(而非基因组DNA)释放到细胞质中,以更有效地激活cGAS-STING通路,同时减少潜在的副作用。
- 增强通路激活效率:利用锰离子(Mn2+)等物质增强cGAS对低浓度DNA的敏感性,或者优化治疗性cGAMP的递送方式(如工程化纳米颗粒),以提高通路激活的效率和持久性。
- 时空可控递送系统:开发智能化的药物递送系统,如光敏剂、超声触发纳米颗粒等,实现药物在肿瘤部位的局部、可控释放,从而减少全身毒性,提高治疗的精准性。
- 细胞类型特异性靶向:通过抗体偶联药物(ADC)等先进技术,将STING激动剂特异性地递送至树突状细胞(DC)或肿瘤相关巨噬细胞等关键免疫细胞,避免对T细胞、B细胞等其他细胞的脱靶损害,从而最大程度地发挥抗肿瘤效应。
2. 探索拮抗策略:有时“关闭”比“激活”更好
鉴于慢性cGAS-STING激活可能驱动炎症并导致T细胞耗竭,科学家们也在探索在特定情况下抑制慢性STING信号或相关促炎通路(如JAK-STAT通路)的策略。临床前研究和早期临床试验提示,JAK抑制剂可能有助于重塑肿瘤微环境,恢复T细胞功能,并与免疫检查点抑制剂产生协同作用。
3. 精准患者选择:找到最适合的患者
未来的治疗将更加注重患者的个体化特征。通过深入分析患者肿瘤的突变负荷(TMB)、抗原性以及cGAS-STING通路的状态,精准筛选出最有可能从STING激动剂或拮抗剂中获益的患者,从而提高治疗的成功率。
总结:cGAS-STING通路——癌症免疫治疗的未来之光
cGAS-STING通路在癌症中扮演着复杂而关键的角色,它既是身体抵御肿瘤的“固有免疫守护者”,也可能在某些情况下成为“慢性炎症的帮凶”。尽管STING激动剂在临床转化中面临诸多挑战,但其核心的抑癌与免疫激活功能使其仍然是重塑肿瘤微环境、增强免疫检查点抑制剂疗效的极具吸引力的靶点。
克服当前STING激动剂面临的递送难题、稳定性不足、脱靶毒性以及肿瘤异质性等挑战,是未来研究的主攻方向。通过开发新型递送系统、探索巧妙的联合治疗策略(如与表观遗传调节剂、代谢调节剂或免疫检查点抑制剂联用),并谨慎考量患者选择,我们有望将这一充满潜力的通路转化为真正有效的抗癌武器。最终的成功,有赖于我们对cGAS-STING通路生物学更深入的理解,以及对肿瘤免疫微环境更精细的操控。
MedFind将持续关注cGAS-STING通路及其他前沿抗癌研究的最新进展,为您带来最及时、最专业的资讯。如果您对最新的抗癌药物、治疗方案或海外购药渠道有任何疑问,欢迎随时咨询MedFind,我们将竭诚为您提供帮助,共同探索抗癌之路上的每一个希望。





